高三第二次阶段性测试化学(试卷B)
第Ⅰ卷(共48分)
相对原子质量:H—1、C—12、O—16、N—14、S—32、Si—28、Na—23 Al—27、Cu—64
Ag—108
第Ⅰ卷(选择题 共74分)
一、选择题(共有8小题,每小题只有一个正确选项,每小题4分,共32分)
1.只给出下列甲中和乙中对应的量,可以组成一个物质的量的公式的是 ( )
| ① | ② | ③ | ④ | ⑤ | |
| 甲 | 物质微粒数 | 标况气体摩尔体积 | 固体体积 | 非标况物质质量 | 溶液质量百分比浓度 |
| 乙 | 阿佛加德罗常数 | 标况气体体积 | 固体密度 | 物质的摩尔质量 | 溶液体积 |
A.①② B.①②④ C.①②③ D.①②⑤
2.近年来城市管理生活垃圾逐步实施分类投放的办法,其中塑料袋、废报纸、旧橡胶制品
等回收垃圾属于 ( )
A.非金属单质 B.无机物 C.有机物 D.盐类
3.下列除去杂质的方法不正确的是 ( )
| A | 除去NO中的少量NO2 | 通过H2O溶液,收集气体 |
| B | 除去FeCl2溶液中的少量CuCl2 | 加入足量Fe屑,充分反应后,过滤 |
| C | 除去SO2中的少量HCl | 通过Na2SO3溶液,收集气体 |
| D | 除去KCl溶液中的少量K2CO3 | 滴入适量盐酸溶液,直到无气泡产生 |
|
|
|
|
C.HClO D. Na2O Na![]() 2-
2-
5.下列物质的名称分别是 ( )
| 名称 | 硫代硫酸钠 | 多硫化钙 | 过氧化钡 | 超氧化钾 |
| 化学式 | Na2S2O3 | CaSx | BaO2 | KO2 |
试综合上述命名规律,分析思考后回答K2CO3的名称是 ( )
A.多硫碳酸钾 B.三硫代碳酸钾 C.过硫碳酸钾 D.超硫碳酸钾
6.在三支试管中,各注入1mL水,分别加入3mL的乙酸、乙酸乙酯和硝基苯。如下图所示,
|
A.乙酸、乙酸乙酯和硝基苯
B. 硝基苯、乙酸和乙酸乙酯
C.乙酸乙酯、乙酸和硝基苯
D.乙酸乙酯、硝基苯和乙酸
7.在下列比较中,正确的是 ( )
|
C.单质密度Li>Na>K>Rb D.分子键角: >CH4>CH2=CH2>CO2
8.下列溶液中的各组离子,因发生氧化还原反应而不能大量共存的是 ( )
A.AlO![]() 、OH-、Na+、NH
、OH-、Na+、NH![]() B.H+、Na+、NO
B.H+、Na+、NO![]() 、SO
、SO![]()
C.Fe3+、SCN-、SO![]() 、Cl- D.Fe3+、HCO
、Cl- D.Fe3+、HCO![]() 、Cl-、NH
、Cl-、NH![]()
二、选择题(共14小题,每小题有1或2个正确选项,每小题3分,共42分)
9.下列反应的离子方程式正确的是 ( )
A.少量SO2气体通入NaClO溶液中
SO2+H2O+ClO-=2HClO+ SO![]()
B.亚硫酸氢铵溶液与等物质量的氢氧化钠溶液混合
NH![]() +HSO
+HSO![]() +2OH-=SO
+2OH-=SO![]() +NH3+2H2O
+NH3+2H2O
C.Fe2O3溶于过量的氢碘酸中
Fe2O3+6H+=2Fe3++3H2O
D.向磷酸氢二钠溶液中加入过量澄清石灰水
2HPO![]() +3Ca2++2OH-=Ca3(PO4)2↓+2H2O
+3Ca2++2OH-=Ca3(PO4)2↓+2H2O
10.设NA代表阿佛加德罗常数,下列说法中正确的是 ( )
①常温常压下,17g甲基(—14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标况时,22.4L二氯甲烷所含有的分子数为4NA
⑥常温常压下,1mol氦气含有的核外电子数为4NA
A.①② B.②④ C.③④ D.⑤⑥
11.将甲、乙两种非金属的性质相比较,知道
①甲比乙容易与H2化合;
②甲原子能与乙的阴离子发生氧化还原反应;
③甲的最高价氧化物的水化酸性比乙的最高价氧化物的水化物酸性强;
④与某金属反应时甲原子得电子数目比乙的多;
⑤甲的单质熔、沸点比乙低。
能说明甲比乙的非金属性强的是 ( )
A.①④ B.③⑤ C.①②③④⑤ D.①②③
12.下列各组中的离子能在同一溶液中大量共存,用足量盐酸酸化后,溶液仍然澄清透明且
颜色无变化的是 ( )
A.K+ Ba2+ HCO![]() NO
NO![]() B. Mg2+ NO
B. Mg2+ NO![]() SO
SO![]() Fe2+
Fe2+
C.Na+ Ca2+ Cl- HPO![]() D.Na+ K+ OH-
AlO
D.Na+ K+ OH-
AlO![]()
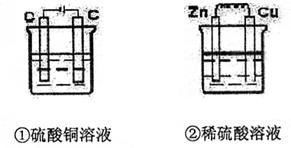
13.下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作
一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确
|
A.溶液的pH变化:①减小②增大
B.电极上析出固体质量①<②
C.电极反应式:①中阳极:4OH-——4e-=2H2O+O2↑②中负极2H++2e-=H2↑
D.产生气体体积①=②
|
向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数 ( )
A.不变 B.减小 C.增大 D.无法判断
15.下列各选项所述的两个量,前者一定大于后者的是 ( )
①F2和Br2的沸点
②纯水在25℃和80℃时的PH值
③同温下分别在100g水中最多能溶解的无水CuSO5和CuSO5·5H2O的质量
④25℃时,等体积的PH值都等于3的盐酸和AlCl3溶液中,已电离的水分子数
⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数
⑥耐火材料MgO和CaO的熔点
⑦H-和H+离子半径
⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
|
16.恒容下的2SO2+O2 2SO3+Q,达到平衡后,下列可以加快反应速率的方法是( )
A.将SO3分离出一部分 B. 升温
C.充入少量N2,增大压强 D.充入少量SO3气体
17.用特殊的方法把固体物质加工纳米级(1nm=1×10-9m)的超细粉末粒子,由这些超细粉
末制得的材料叫纳米材料。某分散系中分散质的微粒直径位20nm,那么该分散系不可
能 ( )
A.产生丁达尔现象 B.加入电解质后发生凝聚
C.通过滤纸 D.通过半透膜
|
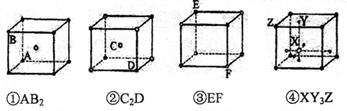
A.② B.① C.③ D.④
19.实验室将Na2SO3和NaClO3按分子个数1:2倒入烧杯中,同时加入适量硫酸,并用水
浴加热,产生棕黄色气体X,反应后测得Na2SO3和NaClO3恰好完全反应,则X为( )
A.Cl2 B.Cl2O C.Cl2O2 D. ClO2
20.镁铁混合物4.9g,溶解在过量某浓度和稀硝酸中,完全反应得到标况下气体2.24L(假
设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是( )
A.6g B.S C. 8g D.12g
21.根据热化学方程式:S(s)+O2(g)=SO2(g);△H=-297.23kJ·mol-1分析下列说法正确的
是 ( )
A.S(g)+O2(g)=SO2(g);△H<+297.23kJ·mol-1
B.S(g)+O2(g)=SO2(g);△H>-297.23kJ·mol-1
C.S(g)+O2(g)=SO2(g);△H<-297.23kJ·mol-1
D.S(g)+O2(g)=SO2(g);△H>+297.23kJ·mol-1
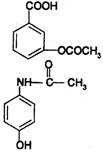
22.在一定条件下,下列药物的主要成分都能发生①取代②加成③水解④中和 四种反应的
|
|
A.阿司匹林 B.维生素
C.扑热息痛 D.芬必得
第Ⅱ卷(非选择题共76分)
三、填空题(58分)
23.(15分)
(1)指出在使用下列仪器(已净)或用品的第一步操作:
| 石蕊试纸检验气体 | 容量瓶 | 集气瓶收集氯化氢 |
(2)下面是中学化学实验常见的几种定量仪器:
A.量筒 B.容量 C.滴定管 D.托盘天平 E.温度计 F.球形移液管,其中
| 标出仪器使用温度的是 | 标有0刻度,且0刻度在上方的是 | 能够用以精确量取液体体积的是 | 使用A、C时由于俯视读数,使得到的数据比正确数据偏小的是 |
(3)配制一定物质的量浓度为0.2mol/LNaOH溶液500mL,填空并请回答下列问题:
| 应称量NaOH的质量 | 应选用容量瓶的规格 | 除容量瓶外还需要的其它仪器 |
| g | m |
用托盘天平称取固体样品时(1g 以下使用游码),若将样品放在了天平的右盘,读数为10.5g,则所称样品的实际质量为 g。
下列操作对配制的NaOH溶液浓度有偏高影响的是 。
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.将称量的NaOH固体置露在空气的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.整个配制过程中容量瓶不振荡
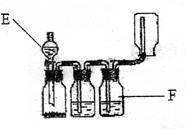
24.(8分)学生晓鸣正在实验室做气体发生、洗涤、干燥、收集(不考虑尾气处理)实验,
|
(1)晓鸣所做的实验是 。
A.锌和盐酸发生氢气
B.二氧化锰和浓盐酸生成氯气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
并指出上述装置中仪器E的名称 ,装置F的名称 。
(2)实验中要用浓硫酸,可是实验室的两瓶硫酸的标签都被腐蚀,分不出哪瓶是浓硫酸,
哪瓶是稀硫酸?你能告诉他两种鉴别浓硫酸方法吗?
方法一:
方法二:
(3)若晓鸣不小心将浓硫酸沾到手上,应该怎么办?
(4)请你提醒晓鸣浓硫酸作为干燥剂可以干燥的气体有(三种或以上)
不能干燥的气体(至少两种)
25.(14分)
(1)(7分)已知CuH在酸性溶液中可发生自身氧化还原反应生成Cu和Cu2+。CuH是一种
难溶物,它会在氯气中燃烧,也能与盐酸反应放出气体。写出这两个化学方程式:
① 反应①中的还原剂是
② 反应②中消耗65gCuH时,转移的电子数是 moL.
(2)(3分)家用液化气中主要成分之一是丁烷。当10kg丁烷完全燃烧并二氧化碳和液态水
时(101kPa),放出热量5×105kJ。丁烷的燃烧热为 ,丁烷燃烧
的热化学方程式为
(3)(4)设XYZ代表三种元素,已知X+和Y-两种离子具有相同的电子构型,Z元素原子
核内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成四核42电子的-1
价阴离子,则可以推知:
Y元素是 Z元素是
由XYZ三元素形成的68电子的盐类化合物的化学式是
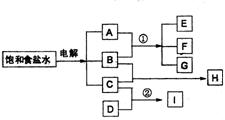
26.(6分)下图每一方框中的字母代表一种反应物或生成物
|
| ||||||||||||||||
物质A和B反应生成物质E、F和G,物质C和D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如表格所示,请填写下列空白:
(1)反应物H的分子式是
(2)反应①的离了方程式是
(3)反应②的化学方程式是(须注明反应条件)
27.(6分)某化合物A的分子式C10H10O4,A不能FeCl3溶液发生显色反应,A在稀硫酸中加热能生成B、C、D三处化合物,B能与FeCl3溶液发生显色反应,C的含碳质量分数为40%,化合物D含氧质量分数为50%。
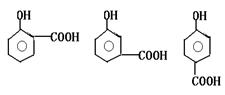
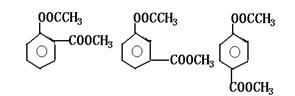
(1)写出化合物C、D的结构简式 、
(2)写出化合物B可能的结构简式
(3)写出化合物A可能的结构简式
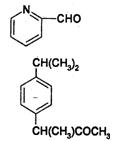
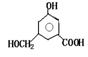
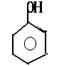
29.(9分)A、B、C、D均为含苯环的化合物,且式量B>A>C,已知有机物A的结构简式
|
(1)A既能与NaOH溶液反应,又能与NaHCO3溶液反应,写出A和NaHCO3溶液反应的
化学方程式
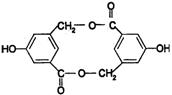
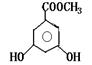
(2)有机物B在浓H2SO4存在下,相互作用生成一种环状酯,如图
|
则有机物B的结构简式为 ,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为 。
(3)D和B互为同分异构体,且苯环上的一氯代物只两种,D不与NaHCO3反应,能与Na、
NaOH反应,等质量的D消耗Na、NaOH的物质的量之比为2:3,则D的结构简式为
(只写一种)。
(4)1molA、C完全燃烧,消耗O2的质量相等,且1molC能和1molNa完全反应,写出含
碳原子数最少的C的结构简式
四、计算题(18分)
29.(6分)某温度下,将一定量的密度为1.15g/L的NaCl溶液电解(惰性电极),设NaCl
恰好完全电解且无其它反应发生时,得到的溶液中氧元素的质量分数为80%。
求:(1)电解后溶液中溶济和溶质的物质的量之比。
(2)原溶液的物质的量浓度。
30.(12分)在100℃时,将0.100mol的四氧化二氮气体充入1 L抽空的密闭容器中,隔一
定的时间对该容器内的物质进行分析,得到如下表格:
| 浓度 | 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4)moL·L-1 | 0.100 | C1 | 0.0005 | C3 | a | b | |
| C(NO2)moL·L-1 | 0.000 | 0.060 | C2 | 0.120 | 0.120 | 0.120 | |
试填空:
(1)该反应的化学方程式为
达到平衡时四氧化二氮的转化率为 %
表中C2 C3、a b(填 > < =)
(2)20s时四氧化二氮浓度C1= moL·L-1
0s~20s四氧化二氮的平均反应速率为 moL·L-1·s-1
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,
二氧化氮的起始浓度是 moL·L-1
高三化学(试卷B)参考答案
第I卷(A)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| B | C | C | A | B | C | B | B | D | B | D | AD |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | ||
| A | C | C | BD | D | B | CD | B | CD | AC |
第Ⅱ卷(76分)
三、填空题(58分)
23.(15分)(1) 用蒸馏水润湿 检查瓶口是否漏水 干燥集气瓶
(2)ABCEF C BCF C
(3)4.0g 500mL 烧杯 玻璃棒 胶头滴管等 9.5g CDE
24.(1) A 分液漏斗 洗气瓶。
(2)方法一:用玻璃棒 分别蘸取两种酸滴加到滤纸上,使滤纸变黑的酸为浓硫酸
方法二:分别取两种酸适量于试管中,各加入一小片Cu,Cu片溶解并有气泡产生的
是浓硫酸
其它方法也给分。①加少量蒸馏水,放热,则为浓硫酸;②手掂分量,重者密度大为浓硫酸;③观察状态,略微摇动,呈油状粘稠液体为浓硫酸④加入Fe片,不反应为浓硫酸⑤加入胆矾,颜色改变者为浓硫酸。
(3)先用干布迅速拭去,再用大量水冲洗
(4)(三种或以上)H2 Cl2 SO2等 (至少两种) H2S NH3
25.(14分)(1)(7分)
①2CuH+3Cl2=2CuCl2+2HCl 、CuH、②2CuH+2HCl=2CuCl2+Cl2+2H2↑2 mol
(2)(3分)2900kJ·mol-1, C4H10(g)+6.5O2(g)=4CO2+5H2O(1);△H=-2900kJ·mol-1
(3)(4分): 氯 氧 KClO4
|
27.(6分)(1)CH3COOH CH3OH (2)
|
(3)
|
|
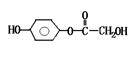
(1)HO— —COOH+NaHCO3=HO— —COONa+CO2↑+H2O
|
(2) ,3:2:1
| |||
| |||
(3) 或 (只写一种)
|
(4)
四、计算题(18分)
29.(6分)(1)10:1 (2)4.8 mol/L
28.(12分) (1) N2O4(g)=2NO2(g) 60% C2>C3 a=b
(2)0.07 ,0.0015 (3) 0.2