高三第二次考试化学试卷
本试卷可能用到的数据:H:1 C:6 N:14 S:32 Cl:35.5 Ca:40 Cu:64 Ba:137
一、选择题(每小题只有一个选项符合题意,3×15=45分)
1.下列说法不正确的是
A.非金属氧化物都是酸性氧化物 B.酸酐不一定都是氧化物
C.有金属光泽的单质不一定是金属 D.既能跟酸反应又能跟碱反应的物质不一定呈两性
2.已知亚磷酸(H3PO3)只能生成两种钠盐(NaH2PO3)和(NaHPO3),由此可知正确的说法
A.亚磷酸中的磷呈+5价 B.亚磷酸是二元酸
C.亚磷酸有两种酸式盐 D.亚磷酸无正盐
3.下列四种物质,只能跟氢氧化钠作用,不能跟盐酸作用的是
A.NaHS B.NaAlO2 C.KHSO4 D.CH3COONH4
4.K2CO3样品中含Na2CO3、KNO3、Ba(NO3)2中的一种或二种杂质,将7.8g该样品溶于足量水得到澄清溶液,再加入过量CaCl2可得5.0g沉淀,则原样品中所含杂质是
A.肯定是Na2CO3,没有Ba(NO3)2 B.肯定是KNO3,没有Ba(NO3)2,可能有Na2CO3 C.肯定没有Na2CO3,Ba(NO3)2 D.无法判断
5.我国内蒙古的白云鄂拥有世界上最大的稀土元素矿藏,提炼时使稀土元素(以R表示)与铁、锰等分离的方法之一是将已处理后的矿石的硫酸浸出液中加入Na2SO4粉末,使稀土元素的硫酸盐转化为沉淀:R2(SO4)2+Na2SO4+xH2O![]() Na2SO4·R2(SO4)3·xH2O
Na2SO4·R2(SO4)3·xH2O
有关判断正确的是
A.反应要在碱性溶液中进行 B.该反应原理属于复分解反应
C.生成的沉淀物属于复盐 D.反应表明Na2SO4的溶解度更小
6.某温度下,在饱和CuSO4溶液中,加入少量无水CuSO4,则溶液的
A.浓度增大 B.浓度不变 C.质量不变 D.质量增加
7.已知土壤胶体带负电荷,因此在水稻田中,施用含氮量相同的下列化肥时,肥效损失最多的是
A.硫铵 B.碳铵 C.硝铵 D.氯化铵
8.300mL某浓度NaOH溶液中含溶质60g,现欲配1mol·L-1 NaOH溶液,应取原溶液与蒸馏水的体积比约为
A.1:5 B.1:4 C.2:1 D.2:3
9.某温度时,CuSO4的溶解度是25g,若温度不变,将32g无水CuSO4粉末投入mg水中,形成饱和溶液并有胆矾晶体析出时,则m的取值范围是
A.18g≤m≤128g B.36g<m<180g C.18g<m<128g D.36g≤m≤180g
10.NA为阿伏加得罗常数,下列叙述正确的是
A.18gD2所含电子数为10NA B.16g氧气和16g臭氧含有的原子数都是NA
C.6g14C含有的中子数为3.5NA D.常温常压下,1立方米水中含有的H+(或OH-)离子数为10-14NA
11.ag某气体含有分子数为b,该cg气体在标态下的体积是(N表示阿伏加得罗常数)
A. B. C. D.
12.氯气跟碘在加热条件下,以等物质的量进行反应,可得到一种红棕色的液体ICl,ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式为:
2ICl+2Zn==ZnCl2+ZnI2 ICl+H2O==HCl+HIO
下列说法正确的是
A.ZnCl2既是氧化产物,又是还原产物
B.ICl跟H2O的反应是自身氧化反应反应
C.ZnI2既是氧化产物,又是还原产物
D.在ICl跟H2O的反应中,ICl是氧化剂,H2O是还原剂
13.下列叙述正确的是
A.元素的单质可由氧化或还原含该元素的化合物制得
B.得电子越多的氧化剂,其氧化性就越强
C.阳离子只能得电子被还原,只能作氧化剂
D.含有最高价元素的化合物一定具有强的氧化性
14.下列物质加入水中显著吸热的是
A.固体NaOH B.浓硫酸 C.生石灰 D.固体NH4NO3
15.在相同温度下,已知:2H2(g)+O2(g)=2H2O(g);ΔH=-Q1 ;2H2(g)+O2(g)=2H2O(l);ΔH=-Q2 ;H2(g)+O2(g)=H2O(l);ΔH=-Q3;则Q1、Q2、Q3的大小关系正确的是
A.Q1=Q2=Q3 B.Q3=Q2>Q1 C.Q3<Q2<Q1 D.2Q3=Q2>Q1
二、填空题
16.配平下列化学方程式
⑴ KMnO4+ HCl== KCl+ MnCl2+ Cl2+ H2O
⑵ P+ CuSO4== Cu3P+ H3PO4+ H2SO4
17.PbO2是很强的氧化剂,在酸性溶液中可将Mn2+氧化成MnO4-,取一支试管加入少量的PbO2固体和2mL 6mol·L-1H2SO4溶液,然后滴入2mL 2mol·L-1MnSO4溶液,试回答:⑴搅拌后,溶液的颜色变化是___________________________
⑵反应的化学方程式是_____________________________________
⑶能否用盐酸来代替H2SO4___________(填能、不能)。并用化学方程式回答_______________________________________________。
18.火箭推进器中盛有强还原剂液体肼(N2H4)和强氧化剂液体双氧水,当它们混合反应时产生大量氮气和水蒸气,并放出的量的热。已知0.4mol液体肼与足量的液体双氧水反应,放出256.6kJ的热量。
⑴反应的热化学方程式为_______________________________________________
⑵已知H2O(l)==H2O(g);ΔH=44kJ·mol-1,则有16g液体肼与液体双氧水反应生成氮气和液态水时放出的热量是___________________kJ
⑶此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是__________________________
⑷已知①P4(固,白磷)+5O2(气)==P3O10(固);ΔH=-2983.2kJ·mol-1
②4P(固,红磷)+5O2(气)==P4O10(固);ΔH=-2738.5kJ·mol-1。由此白磷转化为红磷的热化学方程式为________________________________。则可知白磷的稳定性比红磷_________。(填“强”或“弱”)
19.中国是世界上的文明古国,颜料应用也特别早,朱砂(或称丹砂)就是一种朱红色的颜料,距今4000多年前我国就已使用朱砂作颜料了。试用下面的实验来确定朱砂的元素组成,并回答下列问题:
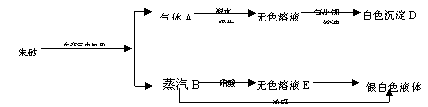 |
⑴写出A、B、C、D、E和朱砂的分子式。
⑵写出A转化为C的化学方程式。
20.标况下,用一定的水吸收氨气后制得浓度为12mol·L-1,密度为0.915g/cm-3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水(水的密度以1.00g/cm-3)。
1.A 2.B 3.C 4.B 5.C 6.B 7.C 8.B 9.C 10.B 11.A 12.C 13.A 14.D 15.D
16.⑴2 16 2 2 2 5 8 ⑵11 15 24 5 6 15
17.⑴又无色变为紫色 ⑵5PbO2+2MnSO4+3H2SO4==5PbSO4+2HMnO4+2H2O
⑶不能;PbO2+4HCl==PbCl2+Cl2↑+2H2O
18.⑴N2H4(l)+2H2O2(l)==N2(g)+4H2O(g);ΔH=-641.5kJ·mol-1 ⑵408.75
⑶产物无污染;⑷P4(固,白磷)==4P(固,红磷);ΔH=-244.7kJ·mol-1 ;弱
19.⑴SO2 Hg HBr或H2SO4 BaSO4 Hg(NO3)2
⑵SO2+Br2+2H2O==2HBr+H2SO4
20. 378L