高三第四次月考化学试卷B
本试卷分为第Ⅰ卷和第Ⅱ卷,考试时间为90分钟,满分为100分
本试卷可能采用的相对原子质量:H—1, C—12,N—14,O—16,S—32
第Ⅰ卷(选择题,共44分)
一、选择题(每小题只有1个正确答案,共20分)
1.用NA表示阿佛加德罗常数,下列说法不正确的是
A.标准状态下的辛烷22.4L完全燃烧产生CO2分子数为8NA
 B.18g水中所含电子个数为10
NA
B.18g水中所含电子个数为10
NA
C.46gNO2和46gN2O4中所含原子数均为3 NA
D.1L2mol·L-1的Mg(NO3)2溶液中含NO-3个数为4 NA
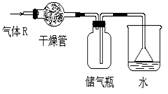
2.在实验室里可按右图的装置干燥、收集气体R,多余的气体可用水吸收,则R是
A.HCl B.Cl2 C.NO2 D.NH3
3.某地区的地表层存在大量KNO3、Na2SO4·10H2O等矿物,你认为该地区的气候特点是
A.干旱 B.多雨 C.旱季雨季分明 D.洪涝
4. 目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以其价键结合,下列叙述不正确的是
A. 该晶体属分子晶体 B. 该分子内原子间都以极性共价键相连接
C. 该物质是一种新化合物 D. 该物质的相对分子质量为2400
5.下列说法正确的是
A.含非极性键的分子一定是非极性分子,含极性键的分子一定是极性分子
B.在所有晶体中不可能有不含化学键的晶体
C.分子晶体中,分子量小的晶体熔点、沸点不一定比分子量大的低
D.晶体中如果存在金属阳离子,则一定存在阴离子
6.咖喱是一种烹饪辅料,若沾到白色衬衣上,用普通肥皂清洗,黄色污渍变成红色,经水漂洗后红色又恢复到黄色,据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用
|
7.某种解热镇痛药的结构简式如右图所示,当它完全水
解时,可得到的产物有
A.2种 B.3种 C.4种 D.5种
|
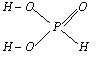
在PCl3中加入蒸馏水,微热,PCl3完全水解,产物之一是
亚磷酸(H3PO3),它的结构见右图。已知:
a.H3PO3与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐;
b.H3PO3与碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀;
c.盛H3PO3的试管中加AgNO3溶液,产生黑色Ag沉淀,试管口处有红棕色气体出现。
8.H3PO3是
(1) 强酸 (2) 弱酸 (3) 二元酸 (4) 三元酸 (5) 氧化性酸 (6) 还原性酸
A.(2)(4)(6) B.(2)(3)(6) C.(1)(4)(5) D.(2)(3)(5)
9.Na2HPO3是
(1) 正盐 (2) 酸式盐 (3) 水溶液呈酸性 (4) 水溶液呈碱性 (5) 水溶液呈中性
A.(1)(4) B.(2)(3) C.(1)(5) D.(2)(4)
10.下列反应中正确的是
(1) b、c反应中均有H3PO4生成;(2) b反应中,生成的黄色沉淀是Ag3PO4;(3) b反应中,生成的黄色沉淀是AgI;(4) b反应中,生成的黄色沉淀是Ag3PO4和AgI;(5) c反应中,还原产物为NO、Ag;(6) c反应中,还原产物为NO2、Ag。
A.(1)(2)(6) B.(4)(6) C.(1)(3)(5) D.(1)(4)(6)
二、选择题(每小题只有1~2个正确答案,共24分)
11.下列物质久置于空气中,会发生颜色改变的是
① 绿矾 ② 氢氧化亚铁 ③ 金属钠 ④ 苯酚 ⑤ 过氧化钠
A.①和③ B.②和④ C.①②和⑤ D.全部
12. 根据“稳定岛假说”,元素周期表的最终界限可能在175号左右,科学家预测114号元素为“类铅”,位于第七周期IVA族,下列有关它的性质的预测中,不正确的是
A. 它的硬度小,熔点较低
B. 它的+4价氯化物具有强还原性
C. 它的金属性比铅强
D. 电解它的硝酸盐和硝酸铜的混和溶液时,它在阴极首先析出
13.下列各组物质只用一种试剂即可鉴别的是
A.CH3CH2OH、 CH2=CHCOOH、 CH3CHO、 CH3COOH
B.苯酚溶液、淀粉KI溶液、乙酸溶液、氢氧化钾溶液
C.裂化汽油、乙酸、甲苯、溴苯、烧碱
D.乙烯、甲醛、乙炔、甲烷、裂解气
14.已知同周期的X、 Y、 Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是:
HZO4>H2YO4>H3XO4,下列判断正确的是
A.原子半径按X、Y、Z的顺序减小
B.阴离子还原性按X3-、Y2-、Z-顺序减弱
C.相同条件下水溶液的pH值Na3XO4 < Na2YO4 < NaZO4
D.单质的氧化性按X、Y、Z的顺序减弱
15.下列可以证明铁的还原性比铜强的实验方案是
A.将铁棒插入硫酸铜溶液 B.铁作阴极、铜作阳极均插入硫酸铜溶液中电解
C.将铜棒插入氯化铁溶液 D.铁片、铜片用导线连接后,两片浸入稀硫酸
16.下列有机物中,对于可能在一个平面上的最多原子数目的判断,正确的是
A.丙烷最多有6个原子处于同一平面上
B.环己烷最多有12个原子处于同一平面上
C.苯乙烯(![]() )最多有16个原子处于同一平面上
)最多有16个原子处于同一平面上
D.CH3CH=CH-C≡C-CF3最多有10个原子处于同一平面上
17.物质的生成热可定义为由稳定单质共生成1mol 物质所放出的热量,如二氧化碳气体的生成热就是C(s)+O2(g)=CO2(g) 的反应热,已知下列几种物质的生成热:
葡萄糖: 1259kJ/mol
H2O (l) 285.8kJ/mol
CO2 393.5kJ/mol
则1kg 葡萄糖在人体内完全氧化成二氧化碳气体和液态水,最多可提供的能量为
A.3225kJ B.2816kJ C.6999kJ D.15649kJ
18.ClSO3H称为氯磺酸,是一种强酸。对于反应:ClSO3H + HCOOH = CO + HCl + H2SO4,有如下判断,其中较合理的是
A.此反应不属于氧化还原反应 B.此反应属于氧化还原反应
C.反应后溶液的pH值变小 D.反应后溶液的pH值增大
第Ⅱ卷(非选择题,共56分)
三、本大题包括3小题(共24分)
19.(8分)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,反应为:4CuI+Hg==Cu2HgI4+2Cu。
(1) 上述反应产物Cu2HgI4中,Cu元素显 ▲ 价;
(2) 以上反应中的氧化剂为 ▲ ,当有1molCuI参与反应时,转移电子 ▲ mol;
(3) CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
Cu2+ + I-== CuI + I3-
20.(6分)周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1:2。写出这些化合物的化学式 ▲ 。
21.(10分)BiCl3水解生成BiOCl(BiOCl难溶于水)。
(1) 写出水解反应的化学方程式______________________▲_____________________;
(2) 医药上把BiOCl叫做次氯酸铋。你同意此名称吗?______▲_______,
理由是_________________________________▲____________________________;
(3) 如何配制BiCl3溶液?_______________________▲_________________________;
(4) 把适量固体BiCl3置于NaCl溶液可得澄清溶液,请说出可能的原因。
__________________________________▲___ _____________________________。
四、本大题包括2小题(共20分)
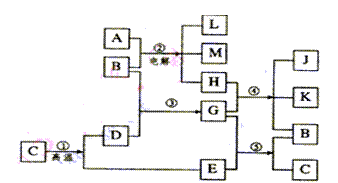 22.(10分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
22.(10分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
(1)单质L是 ▲ ;
(2)化合物B是 ▲ ;
(3)图中除反应①以外,还有两个用于工业生产的反应,是 ▲
和 ▲ (填代号)。它们的化学反应方程式分别是 ▲
和 ▲ 。
23.(10分)氧化二氯是具有刺激性气味的棕黄色气体,沸点38℃,熔点-116℃.制备时
生成的Cl2O要冷却成固态以便操作和贮存。它与一般有机物接触会发生爆炸,遇水较易溶解(1∶100)生成次氯酸溶液。制备少量固态Cl2O可用干燥的Cl2与HgO反应,生成Cl2O和HgO·HgCl2.装置如下图:
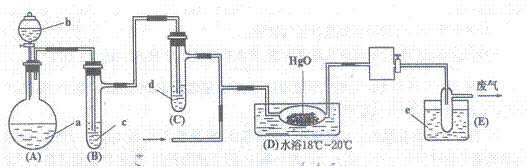 试回答:
试回答:
(1)(A)中盛有的固体试剂a是 ▲ ,分液漏斗中试剂b是 ▲ ;
(2)(B)中盛液体c是 ▲ ;(C)中液体d的作用是 ▲ ;
(3)(D)中发生化学反应的化学方程式是 ▲ ;
(4)(E)为保温式冷浴,其中盛有致冷剂e是 ▲ (在干冰,冰盐水,液态空气、液氨中选择);
(5)装置(A)、(B)、(C)、间的连接方式与(D)、(E)间的连接方式有明显的区别,这区别是 ▲ 。用这些不同的连接方式的主要理由是 ▲ ;
(6)(D)后活塞封闭采用高度氯化的凡士林,而不用普通凡士林,其原因是
▲ 。
五、本大题包括2小题(共12分)
24.(6分)取标准状况下CH4和过量O2的混合气体840mL,点燃,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0.600g。计算:
(1)碱石灰吸收后所剩气体的体积(标准状况下)
(2)原混和气体中CH4跟O2的体积比
25.(6分)在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4 的固体混合物,加热使之充分反应,下图表示加入固体的的质量与产生气体的体积(标准状况)的关系。试计算:
(1)NaOH溶液的物质的量浓度是_____▲ ______ mol·L-1
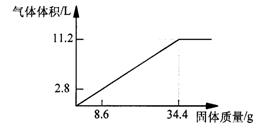 (2) 当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体为 ____▲ ___ L(标准状况)
(2) 当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体为 ____▲ ___ L(标准状况)
(3)当NaOH溶液为180mL,固体仍为51.6g时,充分反应产生的气体为______▲ ___L(标准状况)。