高三第一次月考化学卷
卷I
一、选择题(每一小题只有一个正确答案,共45分)
1、下列化工生产过程所发生的反应不属于氧化还原反应的是 ( )
A、用油脂制肥皂 B、用铝土矿制金属铝
C、用氯气和消石灰制漂白粉 D、用氢气和氮气合成氨
2、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A H2O(g)=H2(g)+1/2O2(g); ΔH=+242kJ·mol-1
B 2H2(g)+O2(g)=2H2O(l) ; ΔH=-484kJ·mol-1
C H2(g)+1/2O2(g)=H2O(g); ΔH=+242kJ·mol-1
D 2H2(g)+O2(g)=2H2O(g) ; ΔH=—484kJ·mol-1
3、下列叙述中,正确的是 ( )
A、含有最高价元素的化合物都具有强氧化性
B、阳离子只有氧化性,阴离子只有还原性
C、原子失去电子数越多,还原性越强
D、强氧化剂和强还原剂混合不一定发生氧化还原反应
4、用石墨电极电解某酸、碱或盐的溶液时,在相同的条件下,阴阳两极收集到的气体的体积比是2∶1,则下列结论正确的是 ( )
A.阴极一定是H2,阳极一定是O2 B.电解后溶液的pH一定变大
C.电解后溶液的pH一定不变 D.电解后溶液的浓度一定变大
5、根据以下4个反应①H2S+I2=S↓+2I-+2H+ ②SO2+2H2S=3S+2H2O
③2I-+Br2=I2+2Br- ④SO2+I2+2H2O=H2SO4+2HI
确定Br-、I-、H2S、SO2 的还原性由强到弱的顺序是 ( )
A、H2S>SO2>I->Br- B、I->Br->SO2>H2S
C、H2S>I->Br->SO2 D、I->Br->H2S>SO2
6、下列离子方程式书写正确的是 ( )
A、SO2气体通入NaClO溶液中:SO2+ H2O+ClO—=== SO42—+ Cl—+2H+、
B、石灰乳中加入Na2CO3溶液:Ca2++ CO32—===CaCO3↓
C、0.1mol·L—1氨水与0.1mol·L—1盐酸混合:H+ + OH— = H2O
D、0.1mol·L—1NH4Cl溶液与0.1mol·L—1NaOH溶液混合:NH4++ OH—==NH3↑+ H2O
![]() 7、在密闭容器中充入4mol
SO2和3mol O2,一定条件下建立平衡:
7、在密闭容器中充入4mol
SO2和3mol O2,一定条件下建立平衡:
2SO2(g)+O2(g) 2SO3(g);△H= —Q kJ·mol—1,测得SO2的转化率为90% ,则此条件下反就放出的热量(kJ)为 ( )
A、1.8Q B、2Q C、Q D、0.9Q
8、在无色透明溶液中,能大量共存的离子组是: ( )
A、Cu2+、Na+、SO42-、Cl— B、H+、Na+、HCO3—、NO3—
C、OH—、HCO3—、Ca2+、Na+ D、Ba2+、Na+、OH—、NO3—
9、右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
A a为负极、b为正极 B a为阳极、b为阴极
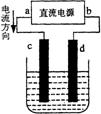 C 电解过程中,d电极质量增加
C 电解过程中,d电极质量增加
D 电解过程中,氯离子浓度不变
10、下列离子方程式中正确的是 ( )
A、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-→BaSO4↓+H2O
B、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-→NH3↑+H2O
![]()
![]() C、苯酚钠溶液中通入少量CO2: -O-+CO2+H2O→ -OH+HCO3-
C、苯酚钠溶液中通入少量CO2: -O-+CO2+H2O→ -OH+HCO3-
D、FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl-
11、若在铜片上镀银时,下列叙述正确的是 ( )
① 将铜片接在电池的正极上, ②将银片接在电源的正极上,
③ 在铜片上发生的反应是:Ag++e—=Ag,
④在银片上发生的反应是:4OH——4e—=O2↑+2H2O,
⑤需用CuSO4溶液, ⑥需用AgNO3溶液作电解液
A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥
12、在一定条件下,PbO2与Cr3+反应,产物是Cr2O72—和Pb2+,则与1mol Cr3+反应所需的物质的量为 ( )
A、 3.0 mol B、 1.5 mol C、 1.0 mol D、0.75mol
![]() 13、蓄电池在放电时起原电池的作用,在充电时起电解池的作用,下式是爱迪生蓄电池内的反应:
下列有关对爱迪生电池的推断错误的是 [ ]
13、蓄电池在放电时起原电池的作用,在充电时起电解池的作用,下式是爱迪生蓄电池内的反应:
下列有关对爱迪生电池的推断错误的是 [ ]
A. 放电时Fe负极,NiO2是正极;
B.充电时阴极上的电极反应式为Fe(OH)2 + 2e = Fe + 2OH-
C、放电时电解质溶液中的阴离子向正极方向移动.
D.蓄电池的电极必须浸入某碱性电解质溶液中.
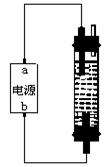 14.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使C12被完全吸收,制得有较强杀毒能力的消毒液,设计了如右图所示的装置,则下列说法不正确的是:( )
14.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使C12被完全吸收,制得有较强杀毒能力的消毒液,设计了如右图所示的装置,则下列说法不正确的是:( )
A. a为正极,b为负极
B. a为负极,b为正极
C.
|
2NaCl +2H2O===== Cl2↑+2NaOH+H2↑
D.生成消毒液的化学方程式为: Cl2+2NaOH==NaCl+NaClO+H2O
15、下列各组离子,在指定的环境中一定能大量共存的是 ( )
A、pH=7的溶液中:Al3+ 、K+ 、SO42—、HCO3—
B、能使pH试纸变深蓝色的溶液中:S2—、SO32—、S2O32—、SO42—
C、加入铝粉放出H2的溶液中:CO32—、AlO2—、I—、NO3—
D、由水电离出c(OH— )=1×10—3mol·L—1的溶液中:Fe2+、NH4+、Cl—、、SO42—
班级 姓名 学号
卷II
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、 填空题(每空2分,共16分)
16、(将NaBiO3固体(黄色,微溶)加MnSO4和H2SO4的混合液里加热,溶液显紫色(Bi3+无色),配平该反应的离子方程式:
□NaBiO3 + □Mn2+ + □H+ š □Na+ + □Bi3+ + □__ + □__
17.(1)自来水厂用绿矾和氯气一起净水,写出有关反应的离子的方程式:①
② ③ 。
![]() (2)近几年来,某些自来水厂在用 液氯进行消毒处理时,还加入少量液氨,其作用是可以延长液氯杀菌的时间,反应的化学方程式为:
(2)近几年来,某些自来水厂在用 液氯进行消毒处理时,还加入少量液氨,其作用是可以延长液氯杀菌的时间,反应的化学方程式为:
NH3+HClO H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定。试分析液氨可以延长杀菌时间的原因 。
18.甲是刚浸过硫酸钠溶液的滤纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴高锰酸钾溶液。通过一段时间后,发现A、B间的紫红色的圆点向A极移动了一段距离,则于A相连的是电源的______极,可以发现在滤纸上的_______极边缘附近有_______色出现。
 |
三、实验题(每空2分,共44分)
19、有一瓶澄清的无色溶液,其中可能含有Na+、Ba2+、Cu2+、SO42—、Cl-、Br-、CO32—中的某几种,取该溶液进行下列实验:
①取部分溶液加足量稀硝酸,逸出气体;
②取上述逸出气体后的部分剩余溶液,加入足量氯水和四氯化碳,振荡后分层,四氯化碳层呈棕红色;
③取①实验后的部分剩余溶液,加入CaCl2溶液,可见白色浑浊;
④取②实验后的水层部分溶液,加入AgNO3溶液,稀HNO3溶液,有白色沉淀产生。
试回答:(1)原溶液中肯定存在的阴离子是______________________。
(2)肯定不存在的阳离子是_____________,理由是__________________。
(3)不能肯定存在与否的离子是___________,理由是_________________。
(4)写出实验的第①②③步发生及应的离子方程式:第①步:____________________;
第②步:________________________;第③步:___________________________。
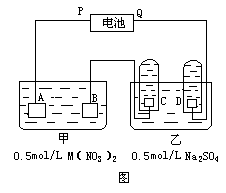 20、下图是两种溶液进行电解的装置。电极A是由金属M制成的,M的硝酸盐的化学式为M(NO3)2,B,C,D都是铂电极,P,Q是电池的两极,电路接通后,电极B上金属M沉淀出来:电极反应为____ __,同时电极C产生______,电极反应为__ ____,电极D产生______,电极反应为__
____。
20、下图是两种溶液进行电解的装置。电极A是由金属M制成的,M的硝酸盐的化学式为M(NO3)2,B,C,D都是铂电极,P,Q是电池的两极,电路接通后,电极B上金属M沉淀出来:电极反应为____ __,同时电极C产生______,电极反应为__ ____,电极D产生______,电极反应为__
____。
(1)电池中P是______极,Q是______极。
(2)A极上电极反应为___ ___。
(3)当电路中通过2.408×1022个电子时,
B极上沉淀出1.27gM,则M的计算式为______。
(4)如果将电池的正负极交换,接入原电路通过1.204×1022个电子时,看到B极上______.电极反应为___ ___,A极上析出______ g ______,电极反应为___ ___(假设M为Cu)。
四、计算题(共5分)
21、一定温度下的质量分数为16.7%的饱和硫酸铜溶液。取一定量此溶液进行电解,当阴极析出的金属质量不在增加时,立即停止通电。此时在阳极收集到气体5.6 L(标况),并得到无色溶液。此时测得溶液的密度为1.074 g/cm3。试求:
(1)该温度下,硫酸铜的溶解度。
(2)电解后所得溶液的质量分数和物质的量浓度。
(3)取1%的电解后的溶液稀释到1 L,求稀释后溶液的pH值。