《氧族元素》针对性练习
一、基础知识点
[基础知识点1]氧族元素的原子结构及其单质和化合物性质递变
1.关于氧族元素的叙述错误的是
A.随着核电荷数的增加,氧、硫、硒、碲元素的金属性逐渐增强
B.H2SO4的酸性比H2TeO4强
C.H2S的还原性比H2Se弱
D.在OF2化合物中氟元素是+1价,氧元素是-2价
2.下列能说明元素R一定为氧族元素的是
A.R为非金属元素,其氧化物对应水化物是强酸
B.R原子的最外层电子层上有6个电子
C.R的单质与H2化合生成H2R
D.R氢化物的水溶液呈酸性
3.按核电荷数的增加,氧族元素的下列性质按递增顺序排列的是
①单质的熔点,②元素的非金属性,③氢化物的还原性,④与H2反应的能力,⑤+6价氧化物对应水货物 的酸性,⑥阴离子的半径.
A.①②③ B.④⑤⑥ C.③④⑤ D.①③⑥
4.钋是原子序数最大的氧族元素,推测钋及钋的化合物最不可能存在的性质是
A.钋是能导电的固体 B.钋与氢气不可能直接化合
C.钋的氧化物和水化物至少有两种 D.钋的氢化物很稳定
5.微量硒(Se)元素对人体有保健作用,我国含有丰富的硒矿资源.已知硒与氧同主族,与钾同周期,下列有关硒元素的性质描述错误的是
A.单质硒既能溶于盐酸又能溶于烧碱溶液产生氢气
B.硒的最高价氧化物的化学式为SeO3
C.硒的非金属性比溴弱,比砷强
D.硒的气态氢化物的化学式为H2Se.H2Se不稳定
6.若已发现了116号元素R,则下列叙述中正确的是
①其钠盐的分子式为Na2R ②其最高价氧化物的水化物是强酸 ③R是金属元素 ④R是非金属元素 ⑤其最高价氧化物的分子式为RO3
A.①③⑤ B.②④ C.③⑤ D.②③⑤
[基础知识点2]臭氧(O3)和双氧水(H2O2)
1. 1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家.大气中的臭氧层可滤除大量的紫外光,保护地球上的生物.氟利昂(如CCl2F2可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3).有关反应为:
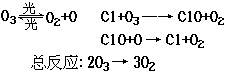
1.在上述臭氧变成氧气的反应过程中,Cl是( ).
(A)反应物 (B)生成物 (C)中间产物 (D)催化剂
2.O3和O2是( ).
(A)同分异构体 (B)同系物 (C)氧的同素异形体 (D)氧的同位素
2.下列各组物质中互为同位素的是( ) ,互为同素异形体的是( )
A.O2 和O3 B.11H和21H C.D2O和H2O D.Na+和Na
3.过氧化氢的沸点比水高,但受热易分解.某试剂厂先制成7%~8%的过氧化氢溶液,再浓缩成30%溶液时,可采用的适宜的方法是
A.常压蒸馏 B.减压蒸馏 C.加生石灰常压蒸馏 D.加压蒸馏
4.过氧化氢与硫酸酸化的高锰酸钾溶液进行反应生成硫酸钾,硫酸锰,水和氧气.如果过氧化氢中的氧原子是示踪原子 (18O),当反应完成后,含有示踪原子的物质是
A.硫酸钾 B.硫酸锰 C.氧气 D.水
5.在稀H2SO4酸化的H2O2溶液中.加乙醚后液体分层,再加入少量的K2Cr2O7溶液并振荡,在乙醚层中出现深蓝色,这是因为生成2CrO5·(C2H5)2O所致.其主要反应的离子方程式为
Cr2O72- + 4H2O2 + 2H+ = 5H2O + 2CrO5
下列叙述中正确的是
A.Cr2O72-被氧化成CrO5 B.该反应属于非氧化还原反应
C.反应中H2O2被氧化成H2O D.此反应可用于检验Cr2O72-离子的存在
6.已知臭氧(O3)具有很强的氧化性,下列物质①SO2 ②CO2 ③CO ④N2 ⑤氟利昂 ⑥NO中,能使臭氧层受到破坏的是
A.①③⑤ B.①③⑤⑥ C.①③④⑤⑥ D.①③④⑤⑥
二、学科内综合
1.下列关于硫和氯两种元素的比较,其中不正确的是
A.硫的原子半径比氯小 B.高氯酸酸性比硫酸强
C.和氢气化合时,氯气比硫易进行 D.氯气可和H2S发生置换反应
2.0.1 mol 某单质跟足量的硫充分反应后,质量增加1.6g,则组成这种单质的元素是
A.铁 B.铜 C.铝 D.钾
3.高空大气层中O2吸收紫外线后可变成O3,O3可按下式分解:O3→O2 + O,O3又和汽车尾气造成的大气污染物NO发生反应:NO + O3 →NO2 + 2O NO2 + O →NO + O2从反应过程和最终产物分析判断,NO是
A.氧化剂和还原产物 B.还原剂和氧化产物
C.氧化剂和催化剂 D.还原剂和催化剂
4.在3S + 6NaOH = 2K2S + K2SO3 + 3H2O反应中,被氧化和被两面派的硫的质量比为
A.1︰2 B.2︰1 C.1︰3 D.3︰1
5.对于氧、硫、硒、碲四种单质,密度最大的是_______,常温下呈_______态;密度最小的是______,常温下为_______态.
6.在常温、常压下,臭氧是一种有_______味的_______体.它的密度比氧气的_______,也比氧气______溶于水.液态臭氧呈________色,沸点为-112.4℃,固态臭氧呈现_____色,熔点为-251℃.
7.硫粉与Na2O2粉未均为淡黄色固体.试举出2种简便方法鉴别它们:
①___________________________________________________________________
②__________________________________________________________________
8.已知硫氧同族,性质相似,请用化学方程式解释下列实验现象:
⑴CS2和Na2S水溶液一起振荡,水溶液由无色变为有色:____________________________
⑵P2S5溶于K2S水溶液中:____________________________________________
⑶Na2S2溶液中加稀盐酸产生浅黄色沉淀:____________________________________
9.据<科技消息>报道:由于废气排放致使地球南极上空的A层出现了400多万平方公理的空洞,有害宇宙线长驱直入,把B分解成密度较小的怪就会逃逸到宇宙空间.剩下的氧最终会使土壤C,从而使地球表面也会变得像火星那样尘暴横行,滴水皆无的荒漠,当今的地球.人类正在重蹈火星的覆辙.根据以上叙述.回答问题:
①填空:A______B________C________
②写出A与B对应的化学方程式:
A:______________________________________
B:________________________________________
10.过氧化氢(H2O2)俗名为双氧水,医疗上可作外科消毒剂.
⑴H2O2的电子式:______________,固态是H2O2为_____________晶体.
⑵将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色消褪了,此时双氧水表现出____性.若用H218O2的双氧水与经酸化的高锰酸钾溶液反应,18O将存在在_______产物中,
⑶向含有酚酞的Na2CO3溶液中滴入双氧水 ,溶液由红色褪至无色;再向该溶液里加入足量的0.1 mol·L-1NaOH溶液,溶液始终不再显红色.主要原因是双氧水具有_________性.
11.地球外层空间存在着微量的臭氧和氧原子.该臭氧层的存在能吸收和阻挡太阳的有害的强烈紫外线辐射.可是人为的大气污染会破坏臭氧层,如超音速排放物中的氮氧化物(NO和NO2),它们和O3及O发生如下反应:O3 + NO = NO2 + O2;O + NO2 = NO + O2
这两处反应反复循环,其总反应式式_____________________________,由此可见氮氧化物在破坏臭氧层的过程中起了__________作用.
12.在标准状况下,750 mL 含O3的氧气,其中的O3若完全分解,其体积变为780 mL (标况).或将此含有O3的氧气1L通入适量的KI溶液中,发生如下反应:
2KI + O3 + H2O =2KOH + I2 + O2↑,则析出I2的质量为多少?
13.硫与硒都属于氧族元素.它们的性质相似.硫、硒的最高价氧化物的水化物的钾盐均为离子化合物且晶型相似,它们的化学式分别为K2SO4和K2SeO4.设K2SO4中含硫的质量分数为A%,K2SeO4中硒的质量分数为B%,若硫元素的相对原子质量为32,硒的相对原子质量设为M,试用硫的相对原子质量、A、B来表示硒的相对原子质量M的表达式(代数式中必须含有A、B)
三、学科间综合
现有两种氧单质O2和OM的混合气体,从其中取出体积相同的两份,往一份中加松节油,OM完全被吸收,结果气体减少了V mL ;加热另一份,使其中OM全部分解成氧气,则气体体积增加(V/2) mL .(以上各气体的体积都是在相同的温度和压强下测定)
⑴根据上述数据推断M的值
⑵OM构成大气层中的_________层,它能阻挡__________照射,从而保护地球上的生物.但是,近年来由于 污染的加重,该层已出现空洞,尤其是含氟化合物的使用,对OM造成的破坏最大,所以现在环保组织倡导生产和使用______冰箱以保护OM层.
2.为了检查酶的作用,做了如下的实验:准备A-G7支试管(容量20 mL ),将各支试管装入下列物质并观察在室温下(25℃)下的反应情况:A.倒入3%的过氧化氢5 mL ,再加入新鲜的鸡肝片1g B.倒入5 mL 水,再加入新鲜鸡肝片1g C.倒入3%的过氧化氢5 mL 和煮沸后的鸡肝片1g D.加入5%的过氧化氢3 mL 和10%的氢氧化钠溶液2 mL 后,再加入新鲜的鸡肝片1g E.加入5%的过氧化氢和10%的盐酸溶液2 mL 后,再加入新鲜的鸡肝片1g F.加3%的过氧化氢5 mL ,再加入二氧化锰1g. g.倒入水5 mL 后,再加入二氧化锰1g
请根据上述实验情况回答下列问题
⑴A试管中观察到发生气泡,请写出溶液中发生反应的化学
_________________________________________________________
⑵在B到G的试管中,请回答与A试管产生同样的气体的是哪些试管
_______________________________________
⑶在A试管中,当反应开始15min后,没有气泡.若要使其重新发生气泡就怎样处理?请在下列选项中,选出一个最合适的选项:_____________
甲:再加入 1g新鲜的鸡肝片 乙:再加入5 mL 3%的过氧化氢
丙:将试管水浴加热到37℃ 丁:将试管冷却到4℃
一、基本智能训练
热点1:1:D 2:B、C 3.D 4.D 5.A 6.C
热点2:1.①D ②C 2.B A 3.B 4.C 5.AC 6.B
二、学科内综合
1.A 2.BD 3.D 4.A 5.碲 固 氧 气
6.特殊臭 气 大 易 深蓝 紫黑
7.①分别加入水,有气泡产生的是Na2O2
②分别点燃,能燃烧的是硫粉
8.⑴CS2 + Na2S = Na2CS3 ⑵P2S5 + K2S = 2KPS3 ⑶Na2S2 + 2HCl = 2NaCl + S↓+H2S↑
9.①A.臭氧 B.水 C.酸化
②A.2O3 ![]() 3O2
B.2H2O
3O2
B.2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
10.⑴电子式:略 绿
⑵还原O2 ⑶氧化
11.O3 + O = 2O2 催化剂
12..0.91g
13.![]()
三、跨学科综合
1.⑴M=3 ⑵臭氧、紫外线、无氟
2.⑴.2H2O2![]() 2H2O + O2↑ ⑵F ⑶乙
2H2O + O2↑ ⑵F ⑶乙