高三学生奥林匹克竞赛(预赛)化学试题
化学试题
相对原子质量:H:1
C:12 N:14 O:16
F:19 Na:23 P:31 S:32
Cl:35.5 K:39 Mn:55 Fe:56 Cu:64 Zn:65 Ag:108 I:127 Ba:137
1.本试卷共26题,用时2.5小时完成,全卷共150分;
2.可使用计算器。
一.选择题(56分)每小题有1个选项符合题意;每题4分,共14题。
1.在含有硫离子,且能使酚酞变红的无色溶液中,能大量桸的离子组是
A Na+、Cu2+、Br-、Ba2+ B Na+、SO32-、SO42-、K+
C K+、MnO4-、NO3-、Na+ D K+、Ca2+、SO32-、Cl-
2.有一种碘和氧的化合物可以称为碘酸碘,其中碘元素呈+3、+5两种价态,则这种化合物的化学式和应当具有的性质为
A I2O4 强氧化性 B I3O5 强还原性
C I4O9 强氧化性 D I4O7 强还原性
3.过氧化氢俗称双氧水,它是一种液体,易分解为水和氧气,常作氧化剂、漂白剂和消毒剂,为贮存、运输、使用的方便,工业上常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体失效的是
A MnO2 B H2S C 稀盐酸 D NaHCO3
4.下列生成Na2S2O3的反应中不可能实现的是
A Na2SO3+S=Na2S2O3
B 3Na2SO4+4S十H2O=3Na2S2O3+H2SO4
C 4SO2+2H2S+6NaOH=3Na2S2O3+5H2O
D 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
5.实验室可用下图所示装置干燥、收集某气体R,并吸收多余的R,则R是
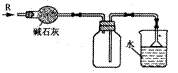
A CH4 B HCl C Cl2 D NH3
6.解热镇痛药Aspirin的结构式为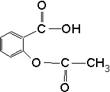 ,1 mol Aspirin在加热情况下与足量的NaOH溶液反应,最多可消耗NaOH物质的量为
,1 mol Aspirin在加热情况下与足量的NaOH溶液反应,最多可消耗NaOH物质的量为
A 1 mol B 2 mol C 3 mol D 4 mol
7.已知80Hg是ⅡB族元素,第七周期ⅡB族元素的原子序数是
A 112 B 98 C 88 D 82
8.某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等4种阴离子。若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是
A CH3COO- B SO32- C CO32- D HCO3-
9.已知甲醛(![]() )分子中四个原子是共平面的,下列分子中所有原子不可能同时存在于同一平面上的是
)分子中四个原子是共平面的,下列分子中所有原子不可能同时存在于同一平面上的是
A
![]() B
B 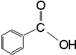 C
C ![]() D
D 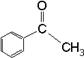
10.下列画有横线的物质在反应中不能完全消耗的是
A 将含少量CO2的CO气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃
B 将l mol Mg置于10 L空气(标况)中,使之在高温下反应
C 标准状况下,将11.2L H2S与22.4L O2混合点燃
D 在强光持续照射下,向过量的Ca(ClO)2上悬浊液中通入少量CO2
11.某白色固体可能由①NH4Cl、②AlCl3、③NaCl、④AgNO3、⑤KOH中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀产生。则对原固体的判断不正确的是
A 肯定存在① B 至少存在②和⑤
C 无法确定是否有③ D 至少存在①、④、⑤
12.将一定量铁粉和硫粉的混合物共热,充分反应后冷却,再加入足量稀硫酸,得到标准状况下的气体11.2L,则原混合物的组成可能是(n代表物质的量)
A n(Fe)<n(S),总质量等于44g B n(Fe)>n(S),总质量等于44g
C n(Fe)=n(S),总质量大于44g D n(Fe)>n(S),总质量小于44g
13.由于碳碳双键(![]() )中的π—键不能自由旋转,因此
)中的π—键不能自由旋转,因此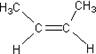 和
和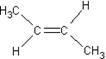 是两种不同的化合物,互为顺反异构体。则分子式为C3H4Cl2的化合物的烯烃异构体有
是两种不同的化合物,互为顺反异构体。则分子式为C3H4Cl2的化合物的烯烃异构体有
A 4种 B 5种 C 6种 D 7种
14.某密闭容器中放入一定量的NO2,发生反应2NO2(g)![]() N2O4(g)+Q,在达平衡后,若分别单独改变下列条件,重新达到平衡后,能使平衡混合气体平均相对分子质量减小的是
N2O4(g)+Q,在达平衡后,若分别单独改变下列条件,重新达到平衡后,能使平衡混合气体平均相对分子质量减小的是
A 通入N2 B 通入NO2 C 通入N2O4 D 降低温度
二.(共2小题,共18分):
15.(8分)实验室用下图所示装置制备溴苯
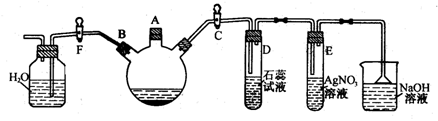
①关闭F活塞,打开C活塞,在装有少量苯的三口烧瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,则三口烧瓶中发生反应的化学方程式为:
②D试管内出现的现象为:
E试管内出现的现象为:
③待三口烧瓶中的反应即将结束时(此时气体明显减少),打开F活塞,关闭C活塞,可以看到的现象是
④反应完毕后的混合物中产物溴苯在上层还是下层?如何分离?
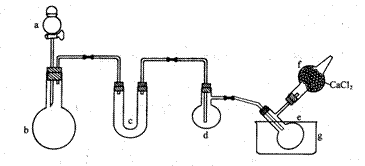
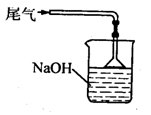
16.(10分)用下图所示装置(酒精灯、铁架台等未画出)制取三氯化磷,在短颈分馏烧瓶d中放入足量白磷,将Cl2迅速而又不间断地通入d中,氯气与白磷会发生反应,产生火焰。
三氯化磷和五氯化磷的物理常数如下:
| 熔点 | 沸点 | |
| 三氯化磷 | -112℃ | 76℃ |
| 五氯化磷 | 148℃ | 200℃分解 |
图中a、b应该装入的试剂或药品分别是浓盐酸和二氧化锰,并在b仪器处加热。请据此回答下列问题:
①蒸馏烧瓶e中收集生成的三氯化磷,为保证三氯化磷蒸气冷凝,应在水槽g中加入
②三氯化磷遇到水蒸气强烈反应,甚至发生爆炸,所以d、e仪器及装入其中的物质都不能含有水分。为除去Cl2中的水分,c中应装入 作干燥剂。
③实验室将自磷保存于水中,取出的白磷用滤纸吸干表面水分,浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。已知水与酒精互溶,酒精与乙醚互溶,乙醚极易挥发,用上述方法除去水分的原因是
④为防止Cl2污染空气,装置末端导出的气体应如何净化处理,画出装置图并注明使用药品: 。
三.(共3小题,共20分)
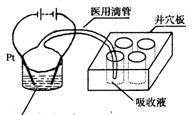 17.(6分)有一种模拟电化学方法处理废水的微型实验,其基本原理是在电解过程中使低价金属离子Mn+(例如Co2+)氧化为高价态的金属离子,然后以此高价态的金属离子作氧化剂把废水中的有机物氧化分解成CO2而净化。该电化学净化法又称间接电化学氧化。其阳极反应式为:Mn+-e‑→M(n+1)+。若现按右下图所示进行实验,试回答下列问题:
17.(6分)有一种模拟电化学方法处理废水的微型实验,其基本原理是在电解过程中使低价金属离子Mn+(例如Co2+)氧化为高价态的金属离子,然后以此高价态的金属离子作氧化剂把废水中的有机物氧化分解成CO2而净化。该电化学净化法又称间接电化学氧化。其阳极反应式为:Mn+-e‑→M(n+1)+。若现按右下图所示进行实验,试回答下列问题:
①井穴板穴孔内应盛放
溶液以便检验电解时产生的C02气体,现象是
②写出电解过程中的电极反应式:
![]() 阳极:
阳极:
阴极:
③写出M(n+1)+氧化有机物(以甲醇为代表)的离子方程式
18.(4分)碳纳米管(CNTs—Carbon Nanotubes)的发现是材料科学研究领域的一个新的突破,它又称巴基管(Buckytube),属富勒(Fullerene)碳系,是伴随着C60的研究不断深入而出现的。碳纳米管是处于纳米级范围内,具有完整分子结构的新型材料。典型的碳纳米管直径小于100nm,长度为几μm。(注:lnm=10-9m,1μm=10-6m)
CNTs的基本结构主要由六边形碳环组成,此外还有一些五边形碳环和七边形碳环:
①这些五、七边形碳环在碳纳米管的什么位置比较多?
②你认为碳纳米管可能具有超导特性吗?为什么?
19.(10分)有一黑色化合物A,它不溶于碱液,加热时可溶于浓盐酸而放出黄绿色气体B。将A与KOH和KClO3共热,它就变成可溶于水的绿色化合物C。若将C酸化,则得到紫红色溶液D和黑色沉淀A。用Na2SO3溶液处理D时,也可得到黑色沉淀A。若用H2SO4酸化的Na2SO3溶液处理D,则得到几乎无色的溶液E,而得不到沉淀A。问A、B、C、D、E各为何物?写出有关化学反应式。
A B C D E
四.(共4小题,共30分)
20.(5分)丁二烯聚合时,除生成高分子化合物外,还有一种环状结构的二聚体生成。该二聚体能发生下列诸反应:①加氢生成乙基环己烷;②1mol该二聚体可与2molBr2加成;③氧化时生成β—羧基己二酸。
①试写出二聚体的结构简式
②试写出上述③中氧化反应的化学方程式:
21.(9分)写出下列转化网图中A、B、C、D四个化合物的结构简式;指出①、④、⑤三个反应各属于什么反应类型;写出⑥、⑦两个化学反应方程式。
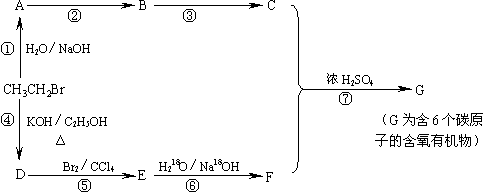
其中化合物B可发生银镜反应,C可与NaHCO3水溶液反应放出气体。
A B C D
反应类型: ① ④ ⑤
反应方程式:⑥
⑦
22.(7分)化合物A的分子式为C6H10O,A可使高锰酸钾溶液褪色。A经催化加氢得B,B与溴化钠和浓硫酸的混合物加热生成C。B经氧化得D,D的分子式也为C6H10O。B在加热下与浓硫酸作用的产物经还原得环己烷。写出A、B.D可能的结构简式。(如有多种可能,尽列之,只考虑位置异构。)
23.(9分)氨基酸分子(![]() )中,既有碱性的氨基(—NH2),又有酸性的羧基(—COOH)。在一定的酸碱性条件下,能自身成盐(
)中,既有碱性的氨基(—NH2),又有酸性的羧基(—COOH)。在一定的酸碱性条件下,能自身成盐(![]() )。所以在氨基酸分析中不能用碱溶液测定氨基酸水溶液中羧基的数目,而应先加入甲醛,使它与—NH2缩合(R-NH2+HCHO→R-N=CH2+H2O),然后再用碱液滴定法,测定羧基含量。氨基酸中—NH2的数目可用与HNO2反应定量放出N2而测得,氨基在反应中变成(—OH)。(R-NH2+HNO2→R-OH+N2+H2O)。
)。所以在氨基酸分析中不能用碱溶液测定氨基酸水溶液中羧基的数目,而应先加入甲醛,使它与—NH2缩合(R-NH2+HCHO→R-N=CH2+H2O),然后再用碱液滴定法,测定羧基含量。氨基酸中—NH2的数目可用与HNO2反应定量放出N2而测得,氨基在反应中变成(—OH)。(R-NH2+HNO2→R-OH+N2+H2O)。
化合物A,分子式为C8H15O4N3。中和l mol A与甲醛作用后的产物消耗1 mol NaOH。1 mol A与HNO2反应放出l mol N2。,并生成B(C8H14O5N2)。B经水解后得羟基乙酸和丙氨酸。
①A的结构简式为
②B的结构简式为
③跟亚硝酸反应的化学方程式为:
五.(共3小题,共26分)
24.(9分)有一瓶(约100mL)硫酸和硝酸的混合溶液,取出10.00mL该混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得到4.66g沉淀。滤液跟2.00mol·L-1NaOH溶液反应,共用去35.00mL碱液时恰好中和。求:
①混合液中H2SO4和HNO3的物质的量浓度;
②另取10.00mL原混合酸溶液,加入1.60g铜粉共热,在标准状况下可收集到多少毫升气体?
25.(9分)一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。
即:AmBn(s)![]() mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
Ksp(Ag2CrO4)=[Ag+][CrO2- 4] =1.1×10-12
试求:
(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小。
26.(8分)化学反应2CuBr2(s)![]() 2CuBr(s)+Br2(g),487K的平衡常数应表示为
2CuBr(s)+Br2(g),487K的平衡常数应表示为![]() ,但对有固体参与的反应,固相物质的分压可以作为常数1,因此,KP可以大为简化,例如上式可表示为KP=P[Br2(g)]=0.0460atm。现有容积为10.0L的容器,其中装有过量的CuBr2(s)并加入0.100 mol I2(g),因发生反应Br2(g)+I2(g)
,但对有固体参与的反应,固相物质的分压可以作为常数1,因此,KP可以大为简化,例如上式可表示为KP=P[Br2(g)]=0.0460atm。现有容积为10.0L的容器,其中装有过量的CuBr2(s)并加入0.100 mol I2(g),因发生反应Br2(g)+I2(g)![]() 2BrI(g)而使平衡时气体总压P=0.746atm,求:
2BrI(g)而使平衡时气体总压P=0.746atm,求:
①2个反应的平衡常数。
②再向体系中充入0.100 mol I2,则平衡时气体总压为多少?
参考答案及评分标准
一、(共56分)每一小题4分。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | B | C | D | B | S | C | A | A | D | C | B | D | D | A |
二、(共18分)
15.(共8分)
①![]() (2分)
(2分)
②D管出现白雾,试液变红;E管生成浅黄色沉淀(2分)
③水通过F塞进入B 三口烧瓶中液体分层(2分)
④溴苯在下层,可用分液漏斗分离。(2分)
16.(共10分)
①冰盐水或冷水(2分)
②无水氯化钙(2分)
③白磷上残留的水溶解在酒精中,残留的酒精又溶解在乙醚中(3分)
④用氢氧化钠溶液吸收。装置图如下:(3分)
三.(共20分)
17.(共6分)
①Ca(OH)2(1分) 生成白色沉淀(1分)
②阳极:2Co2+-2e→2Co3+ (1分)
阴极:2H++2e→H2↑ (1分)
③6Co3++CH3OH+H2O=CO2↑+6Co2++6H+ (2分)
18.(共4分)
①碳纳米管管身弯曲开叉部位,以及两端封闭部分(2分)
②可能。由于这种碳纳米管可以看成石墨结构卷曲而成,所以在它的径向存在自由电子导电,所以可能具有超导性(其它答案只要合理均可给分) (2分)
19.(共10分)
A.MnO2 B.O2 C.K2MnO4 D.KMnO4 E.MnSO4 (5分,每物质1分)
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O(1分)
MnCl2+Cl2↑+2H2O(1分)
3 MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O(1分)
3K2MnO4+KCl+3H2O(1分)
3K2MnO4+2H2SO4=2KMnO4+MnO2+2K2SO4+2H2O(1分)
2KMnO4+3Na2SO3+H2O=2 MnO2+3Na2SO4+2KOH(1分)
2KMnO4+5Na2SO3+3H2SO4=2 MnSO4+5Na2SO4+K2SO4+3H2O(1分)
四.(共30分)
20.(共5分)![]() (3分)
(3分)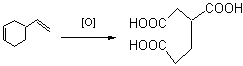 (2分)
(2分)
21.(共9分)
A CH3CH2OH (1分) B CH3CHO (1分)
C CH3COOH (1分) D CH2=CH2(1分)
①取代反应 (1分) ④消去反应 (1分) ⑤加成反应 (1分)
反应⑥:![]() (1分)
(1分)
反应⑦:H18OCH2CH218OH+2![]()
![]()
![]() (1分)
(1分)
22.(共7分)
A
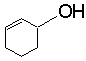 和
和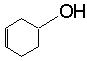 (答对1个给2分,两个都对给3分)
(答对1个给2分,两个都对给3分)
B
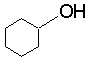 (2分) D
(2分) D 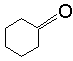 (2分)
(2分)
23.(共9分)
1mol A 与甲醛作用后的产物消耗 1 mol NaOH,1 mol A与HNO2反应放出1 mol N2,说明A分子中有一个游离的—COOH和一个游离的—NH2。
B经水解后得羟基乙酸和丙氨酸,说明—OH原来是一个—NH2,即A由甘氨酸和丙氨酸组成,由A的分子式可知,应有2分子丙氨酸。
①A.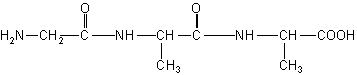 (3分)
(3分)
②B.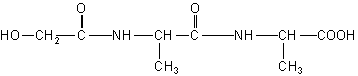 (3分)
(3分)
③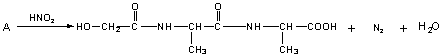 (3分)
(3分)
五.(共26分)
24.(9分)
解:(1)n(H2SO4)=n(BaSO4)=![]() =0.0200 mol
=0.0200 mol
∴c(H2SO4)=![]() (2分)
(2分)
由H+~OH-,设[H+]为x mol·L-1
则x×0.01000L=2.00mol·L-1×0.03500L 解得x=7.00mol·L-1
∴c(HNO3)=7.00-2×2.00=3.00 mol·L-1 (2分)
②3Cu + 2NO3- + 8H+=3Cu2++2NO↑+4H2O
3×64(g) 2(mol) 8(mol) 2×22.4(L)
1.60(g) y z w
y=0.016 (mol) 现NO3-为0.03 mol ∴NO3-过量
z=0.066 (mol) 现H+为0.07 mol ∴H+过量
∴计算NO体积应以不过量的Cu作计算依据,即:
![]() w=0.373
(L)=373 (mL)(5分,列式2分,结果3分)
w=0.373
(L)=373 (mL)(5分,列式2分,结果3分)
25.(9分)
①AgCl(s)![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
![]() (1分)
(1分)
Ag2CrO4(s) ![]() 2Ag+(aq)+CrO42-(aq)
2Ag+(aq)+CrO42-(aq)
2x x (2x)2·x=Ksp
![]() (1分)
(1分)
∴ c(AgCl)<c(Ag2CrO4)
②在0.010 mol·L-1 AgNO3溶液中,c(Ag+)=0.010 mol·L-1
AgCl(s) ![]() Ag+(aq) + Cl-(aq)
Ag+(aq) + Cl-(aq)
溶解平衡时: 0.010+x x
(0.010+x)·x=1.8×10-10 ∵ x很小,∴ 0.010+x ≈0.010
x=1.8×10-8(mol·L-1)
c(AgCl)= 1.8×10-8(mol·L-1) (2分)
Ag2CrO4(s) ![]() 2Ag+(aq) + CrO2-4(aq)
2Ag+(aq) + CrO2-4(aq)
溶解平衡时: 0.010+x x
(0.010+2x)2·x=1.1×10-10 ∵ x很小,∴ 0.010+2x≈0.010
x=1.1×10-10(mol·L-1) ∴ c(Ag2CrO4)=1.1×10-10(mol·L-1)
∴ c(AgCl)>c(Ag2CrO4) (2分)
26.(共8分)
(1)I2的浓度为:![]() (1分)
(1分)
Br2(g) + I2(g) ![]() 2BrI(g)
2BrI(g)
0.0460 0.400
0.0460 0.400-x 2x (1分)
0.0460+0.400-x+2x=0.746
x=0.300 (1分)
K=![]() (1分)
(1分)
(2) Br2(g) + I2(g) ![]() 2BrI(g)
2BrI(g)
0.0460 0.800-y 2y (1分)
![]() (1分)
(1分)
y=0.511(atm) (1分)
P总=0.0460+0.800-y+2y=0.846+0.511=1.357(atm)
答案误差在10%以内得满分,答案有效数字不对每个扣0.5分,共扣1分。