高三月考化学试卷
本卷分为第Ⅰ卷和第Ⅱ卷,考试时间为90分钟,满分为100分
本卷可能用到的相对原子质量:H—1,C—12,O—16,Na—23,S—32,Ca—40,Cu—64
第Ⅰ卷(选择题,共40分)
一、选择题(每小题只有1个正确选项,共16分)
1.下列词汇中,其中所表述的颜色与相关物质的颜色并无密切联系的是
A.赤潮 B.黑烟 C.白色塑料 D.绿色食品
2.水的沸点是100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是―60.7℃,引起这种差异的主要原因是 ( )
A.范德华力 B.共价键 C.氢键 D.相对分子质量
3. 欲从苯酚的乙醇溶液中回收苯酚,有下列操作:①蒸馏 ②过滤 ③静置分液 ④加入足量金属钠 ⑤通入过量CO2气体 ⑥加入足量的苛性钠溶液 ⑦加入足量的三氯化铁溶液 ⑧加入乙酸与浓硫酸混合液加热,合理的操作程序是
A. ④⑤③ B. ⑥①⑤③ C. ⑧① D. ⑧②⑤③
4.下列有关化工生产的叙述正确的是
A.粗铜精炼电解池中,粗铜作阳极
B.氯碱工业中,阳极发生的反应是:2H++2e—=H2↑
C.硫酸工业上,二氧化硫经接触氧化生成三氧化硫后,在吸收塔中用水吸收
D.硫酸工业上,二氧化硫氧化为三氧化硫常采用高压
 5.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。按此密闭体系中气体的流向,则在A处流出的气体为
5.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。按此密闭体系中气体的流向,则在A处流出的气体为
A.SO2 B.SO3,O2 C.SO2,O2 D.SO2,SO3
6.下列反应原理不符合工业冶炼金属实际情况的是
A.2MgO====2Mg+O2 B.4Al+3MnO2====2Al2O3+3Mn
C.2HgO====2Hg+O2 D.4CO+Fe3O4====3Fe+4CO2
7.人体正常的血红蛋白中含有Fe2+,若误服NaNO2,则导致血红蛋白中Fe2+转变为高铁血红蛋白而中毒。服用维生素C可解除NaNO2中毒。下列有关叙述正确的是
A.NaNO2是还原剂 B.维生素 C是氧化剂
C.NaNO2被氧化 D.维生素C将Fe3+还原为Fe2+
8.为除去镀在铝表面的铜层,可选用的试剂是
A.稀硝酸 B.浓硝酸 C.浓硫酸 D.浓盐酸
二、选择题(每小题只有1个正确选项,共24分)
9. 近年来,科学家正在探索利用铝粉作燃料的可能性,以期铝能成为一种石油的取代物。假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为哪项是不正确的是
A. 铝质轻,便于运输、贮存,且安全
B. 铝燃烧时放出的热量大,且燃烧后新产物对环境的污染容易得到有效的控制
C. 在地球上,铝矿资源丰富
D. 现代电冶铝的工业技术已为铝作为新能源奠定了重要基础
10.今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol·l-1。如果甲瓶中加入少量
的NaHCO3晶体m mol,在乙瓶中加入少量的NaHSO3晶体m mol,丙瓶不变,片刻后,甲、乙、丙三瓶中HCIO的物质的量浓度大小关系是(溶液体积变化忽略不计)
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>丙>甲
11.下列画有横线的物质在反应中不能完全消耗的是
A.将含少量H2O(g)的H2通入盛有足量Na2O2的容器中并不断用电火花点燃
B.将l mol Cu置于含2 mo1H2SO4的浓硫酸中加热
C.在强光持续照射下,向过量的Ca(C1O)2溶液中通入少量的CO2
D.在一定条件下,合成氨工业中3体积H2和1体积N2在催化剂存在下反应
12.某温度下,Wg下列各组物质在足量的O2中充分燃烧,其燃烧产物立即与过量的Na2O2 固体反应,该固体增重也是Wg,符合此要求的是①H2 ②CO ③CO、H2 混合气 ④HCHO ⑤CH3CH2OH
A.④⑤ B.①②③ C.①②③④ D.①②③④⑤
|
A.用惰性电极电解MgCl2溶液2Cl-+2H2O Cl2↑+H2↑+2OH-
B.Ca(OH)2溶液中加入过量NaHCO3溶液Ca2++2HCO3-+2OH- CO32-+CaCO3↓+2H2O
C.次氯酸钙溶液中通入过量的CO2 Ca2++3ClO-+H2O+CO2 CaCO3↓+2HClO
D.氢氧化铁溶于碘化氢溶液 Fe(OH)3+3H+ Fe3++3H2O
14.将10mL0.1mol/L氨水与12mL0.1mol/L盐酸混合后,溶液中各种离子的物质的量浓度由大到小的顺序是
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+) B.c(H+)>c(Cl-)>c(NH4+)>c(OH-)
C.c(H+)>c(OH-)>c(Cl-)>c(NH4+) D.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
![]()
![]() 15.向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根CrO2-。其平衡关系如下:Cr3++3OH- Cr(OH)3 CrO2-+H++H2O
15.向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根CrO2-。其平衡关系如下:Cr3++3OH- Cr(OH)3 CrO2-+H++H2O
(紫色) (灰绿色) (亮绿色)
向0.05mol/L的Cr2(SO4)3溶液50mL中加入1.0mol/L的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为
 A.溶液为紫色 B.溶液中有灰绿色沉淀 C.溶液为亮绿色 D.无法判断
A.溶液为紫色 B.溶液中有灰绿色沉淀 C.溶液为亮绿色 D.无法判断
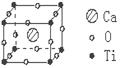
16.许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如右图所示,则该物质的化学式为
A.CaTiO3 B.Ca4TiO3 C.Ca4TiO6 D.Ca8TiO12
第Ⅱ卷(非选择题,共60分)
三、本大题包括4小题(共24分)
17.(4分)现有下列短周期元素性质的数据:
|
性质 |
| |||||||||
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | ||
|
| +2 | +1 | +5 | +7 | +1 | +5 | +3 | |||
| -2 | -3 | -1 | -3 |
请确定以上8种元素在周期表中的位置,将元素编号填入下表中
|
周期 |
| |||||||
| 1 | ||||||||
| 2 | ||||||||
| 3 |
18.(8分)在一定条件下的下列可逆反应达到平衡时,试填出: xA+yB![]() zC
zC
(1)若A、B、C都是气体,减压后平衡向逆反应方向移动,则x、y、z关系是___▲_____;
(2)若C是气体,并且x+y=z,在加压时化学平衡可发生移动,则平衡必定是向 ▲ 方向移动;
(3)若B、C是气体,现增加A物质的量(其他条件不变),平衡不移动,说明A是 ▲ ;
(4)若加热后,C的百分含量减小,则正反应是 ▲ 热反应。
19.(6分)在铝表面着色,先应用电解法使铝表面覆上一层氧化铝,方法是用铝件和另一材料作电极,用碳酸氢钠作电解液进行电解。其原理是通电后铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝件表面形成一层较厚的氧化膜。某校研究性学习小组根据上述原理,以铝件和铁棒为电极,一定浓度的碳酸氢钠作电解液进行实验。
(1).铝件表面形成Al(OH)3薄膜的原因 ▲ ;
(2).电解过程中,必须使电解液的pH值保持相对稳定(不能太大,也不能太小)的理由
▲ ;
(3).用碳酸氢钠作电解液,会减缓阴极区溶液pH值的增大,能说明这一原理的离子方程式是 ▲ 。
20.(6分)铁是自然界里分布最广的金属元素之一,在地壳中的质量约占5%左右。铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe304)、赤铁矿石(主要成分是Fe2O3)等。
(1)写出用赤矿炼铁的主要化学反应方程式________________▲____________________;
(2)红热的铁能跟水蒸气起反应,有一种产物是可燃气体,则其反应方程式为
_____________________________________▲___________________________,
在常温下,铁跟水不起反应。但是,在水和空气里的氧气及二氧化碳等的共同作用下,铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。刷油漆是重要的防腐蚀措施之一,油漆防腐蚀的主要原理是_____________▲________________;
(3)铁元素是人体的重要营养元素,举一例说明铁元素在人体中的重要作用
______________________________________▲______________________________。
四、本大题包括2小题(共22分)
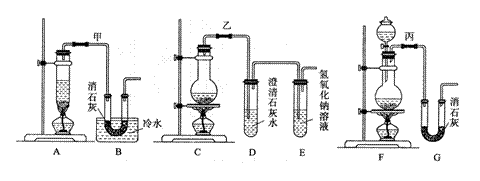 21.(11分)实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2
21.(11分)实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。现有3个同学分别设计的3套实验装置如下图:
(1)写出制取氯气的化学方程式 _▲ ;
(2)请从以下几个方面对甲乙丙3套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表中空格中。
a.不容易控制反应速率; b.容易控制反应速率; c.有副反应发生;
d.可防止副反应发生; e.污染环境; f.可防止污染环境
| 优 点 | 缺 点 | |
| 甲装置 | ▲ | ▲ |
| 乙装置 | ▲ | ▲ |
| 丙装置 | ▲ | ▲ |
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分连接顺序是 _▲ (按气流流动的方向)。该组合中还缺少的装置是 _▲ ,
原因是 _▲ ;
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯
酸钙的物质的量最多不超过 ▲ mol。
22.(11分)某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用图3所示装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
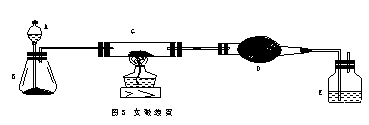
(1)实验目的:________▲_________。
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容(见表1)。
表1 实验步骤,现象及方程
| 实验步骤 | 实验现象 | 有关化学方程式 | ||||
|
|
| |||||
| 打开A的活塞,慢慢滴加溶液 | ▲ | ▲ | ||||
| 对G进行加热,当G中药品充分反应后,关闭A的活塞,停止加热 |
|
| ||||
|
|
|
(4)计算:样品中铜的质量分数=_____▲ ____(用含W,![]() 的代数式表示);
的代数式表示);
(5)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使G中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有学生提出在B与G之间加入一个装置,再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是____▲______。在B与G之间加入的装置可以是______▲_______,其中盛放的药品是_____▲_______。
五、本大题包括2小题(共14分)
23.(8分)已知下列两个热化学方程式;
H2(g)
+ ![]() O2(g) == H2O(l );△H = -285.8kJ/ mol
O2(g) == H2O(l );△H = -285.8kJ/ mol
C3H8(g) + 5O2(g) == 3CO2(g) + 4H2O(l);△H = -2220.0 kJ/ mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热5297.4kJ,试计算混合气体中H2和C3H8的体积比;
(2)已知:H2O(l) = H2O(g);△H = +44.0 kJ/ mol,试写出丙烷燃烧生成CO2和水蒸气的热化学方程式。
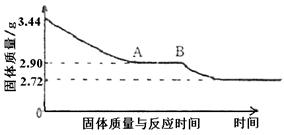
|
求:(必须写出计算过程)
(1)石膏的化学式;
(2)图像中AB段对应化合物的化学式。
 在G中加入样品粉末Wg,D中装入药品后并称量为
在G中加入样品粉末Wg,D中装入药品后并称量为