高三化学综合练习(六)
一、选择题
1.下列物质按“赤、橙、黄、绿、蓝、紫”的颜色顺序编排的是:(B )
①溴水 ②CuSO4 ③KMnO4 ④CuO ⑤AgI ⑥FeSO4·7H2O ⑦CuSO4·5H2O ⑧Fe2O ⑨Ag2S
A.①②③④⑤⑥ B.⑧①⑤⑥⑦③
C.③④⑤⑥⑧② D.⑧⑨⑤⑥②③
2.下列变化属于物理变化的是:(C)
A.熔融态的氯化钠导电;
B.用加热的方法分离氯化钠固体和氯化铵晶体;
C.在氢氧化铁胶体中加入硫酸镁溶液析出红褐色沉淀;
D.将过氧化钠固体溶于水中.
3.下列洗涤不洁净的玻璃仪器的方法中属正确的是:(C)
A.做完制酚醛树脂的试管用水洗涤;
B.做完高锰酸钾制氧气后的试管用稀HCl洗涤;
C.做完碘升华后的小烧杯用酒精洗涤;
D.做完银镜反应后的试管用稀H2SO4洗涤.
4.下列反应在加入少量物质后,反应速度将加快,但该反应不属于催化反应的是:( B )
A.在苯和液溴的混合物中加入少量铁屑;
B.在锌粒和稀硫酸的混合物中加入少量硫酸铜;
C.在镁粉和稀醋酸的混合物中加入少量醋酸钠;
D.在过氧化氢溶液中加入少量二氧化锰.
5.下列说法正确的是(D)
A.氯化钾溶液在电流作用下电离成钾离子和氯离子
B.二氧化碳溶于水能部分转化成离子,故二氧化碳属于弱电解质
C.硫酸钡难溶于水,所以硫酸钡属弱电解质
D.纯净的强电解质在液态时,有的导电有的不导电
6.下列变化不属于化学变化的是 (A)
A.碘晶体受热变为紫色的蒸气
B.加热氯化铵晶体,晶体从试管底部转移到试管口附近
C.在电解质溶液中通上直流电 D.白磷隔绝空气加热变红磷
7.下列物质为纯净物的是(D)
A.纯净的矿泉水 B.医疗用的生理盐水
C.密闭容器中的二氧化氮 D.光导纤维
8.等量的苛性钠溶液分别用PH值为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va和Vb,则两者关系正确的是:(D)
A.Va>10Vb; B.Vb=10Va ; C.Vb<10Va; D.Vb>10Va.
9.已知HF的酸性比HCN的酸性强.现有物质的量、浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液的离子数目为n1,后者溶液中的离子数目为n2,下列关系正确的是:(B)
A.n1=n2; B.n1>n2; C.n1<n2; D.[F-]< [CN-].
10列叙述正确的是: (D)
A.明矾能净水,常用于软化硬水;B.红磷用于制安全火柴,涂在火柴头上;
C.铝密度小,硬度大,故用于制造飞机;
D.醋酸纤维不易着火,用于制电影胶片片基.
11离子方程式正确的是:( D )
A.AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O;
B.C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O![]() 2C6H5OH+CO
2C6H5OH+CO![]() ;
;
C.FeBr2溶液中通入少量Cl2:2Br-+Cl2=Br2+2Cl-;
D.Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO![]() +4OH-=Mg(OH)2
+2CO
+4OH-=Mg(OH)2
+2CO![]() +2H2O.
+2H2O.
12列反应中,有黄色物质生成的是:( AD )
A.鸡蛋白溶液中加几滴浓硝酸混合加热;B.H3PO4溶液中加入AgNO3溶液;
C.苯酚溶液中加几滴FeCl3溶液;D.H2S气体通过灼热的玻璃管.
13列实验中都要使用催化剂,其中催化剂使用错误的是:(AD)
A.用乙醇和过量的3mol/L硫酸的混合液加热制取乙烯;
B.用氯酸钾和少量高锰酸钾加热制取氧气;
C.将苯酚、40%甲醛溶液和少量浓盐酸混合水浴加热,制取酚醛树酚;
D.将少量蔗糖溶液和浓硫酸混合煮沸使蔗糖水解.
14电解KOH溶液时,若阴、阳两极分别为碳和铁,当生成0.1mol Fe(OH)3沉淀时,共消耗amol H2O,产生bLH2(标准状况).则a和b分别为:(A)
A.a=0.1,b=2.24; B.a=0.05,b=2.24;
C.a=0.25,b=4.48; D.a=0.3,b=3.36.
15目前人们正在研究开发一种高能电池——钠硫电池,它是以熔融的钠硫为两极,以Na -导电的β″——Al2O3陶瓷作固体电解质,反应式如下:2Na+xS![]() Na2Sx,以下说法正确的是:( D )
Na2Sx,以下说法正确的是:( D )
A.放电时,钠作正极,硫作负极;B.放电时,钠极发生还原反应;
C.充电时,钠极与外电源的正极相连;
D.充电时,阴极发生的反应为:Sx2--2e=xS.
16列说法正确的是 ( D)
A相同温度下1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中,[OH-]之比是2:1
B 0.1 mol·L-1 NH4Cl溶液中的[NH![]() ]=[Cl-]
]=[Cl-]
C 向0.1 mol·L-1NaNO3 溶液中滴加稀盐酸,使溶液pH=5,此时混合液中[Na+]=[Cl-]
D 向醋酸钠溶液中加入适量醋酸,使 混合液的pH=7,此时混合液中[Na+]=[CH3COO-]
17近,科学家冶炼出了纯度高达99.9999%的铁,根据所学化学知识判断该铁可能具有的性质有(D)
A.与相同浓度的盐酸反应生成氢气的速率比生铁快 B.硬度比生铁高
C.相同条件下比生铁易被腐蚀 D.在冷的浓硫酸中可钝化
18豆酸的结构简式为CH3-CH==CH-COOH,现有①氯化氢②溴水③纯碱溶液④2-丙醇⑤酸化的KMnO4溶液。在一定条件下上述物质能与巴豆酸反应的组合是(D)
A.②④⑤ B.①③④ C.①②③④ D.①②③④⑤
19aAn+、bB(n+1)+、cCn-、dD(n+1)-均是短周期元素形成的简单离子,它们具有相同的电子层结构,下列叙述正确的是(A)
A.离子半径:D(n+1)-> Cn-> An+ >B(n+1)+ B.原子序数:A>B>C>D
C.原子半径:B>A>D>C D.得电子能力:D>C>An+>B(n+1)+
20列事实不能说明亚硝酸是弱酸的是(A)
A.HNO2不与NaCl反应
B.HNO2与同浓度的盐酸溶液作对比导电实验,灯泡很暗
C.NaNO2溶液的pH>7 D.室温下0.1 mol/L HNO2溶液的pH=2.1
二、填空题
21有一种多聚硼酸盐为无限网状结构,右图为
其结构单元示意图,其结构的基本单元可表示为
(B5On)m-,则m、n值分别是(D)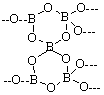
A、2,4 B、3,6 C、2,5 D、3,9
22下表数据是在某高温度下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
| 反应时间 t/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚Y/nm NiO层厚Y′/nm | 0.05a b | 0.20a 2b | 0.45a 3b | 0.80a 4b | 1.25a 5b |
*注:a和b均为与温度有关的常数 。请填空回答:
⑴金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是
反应速率可以用反应物的消耗速率,也可以用产物的生成速率。
⑵金属氧化膜的膜厚Y跟时间t所呈现的关系是(填直线、抛物线、对数或双曲线等类型):MgO氧化膜厚Y属直线 型,NiO氧化膜厚Y′属抛物线 型。
⑶Mg与Ni比较,哪一种金属具有良好的耐氧化腐蚀性:Ni ,其理由是:
它的腐蚀速率随时间的增长比镁的要慢。
23某学生为将含有少量杂质铜的氯化铁提纯.拟定以下实验步骤:
①把样品加蒸馏水溶解;②过滤除去杂质;③把滤液加热蒸干得到FeCl3晶体.
(1)你认为此方案是否科学,试用化学方程式和简要文字表达其理由.
答:
(1)不科学.加水后2FeCl3+Cu![]() CuCl2+2FeCl2,过滤不能除去CuCl2;在 溶液蒸干过程中FeCl3+3H2O
CuCl2+2FeCl2,过滤不能除去CuCl2;在 溶液蒸干过程中FeCl3+3H2O![]() Fe(OH)3+3HCl
Fe(OH)3+3HCl
(2)请你设计提纯氯化铁方案(只要求写出提纯步骤,最多只允许6步完成).
答:①加蒸馏水溶解;②加过量Fe粉;③过滤除去Cu和过量Fe;④通入适量氯气;⑤加入少 量盐酸; ⑥蒸发浓缩结晶得到FeCl3晶体.
24、由于用氯气对饮用水消毒,会使水中的有机物发生氯代,生成有机含氯化合物,于人体有害,世界环保联盟即将全面禁止这种消毒方法,建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(ClO2)。ClO2极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
(1)在ClO2分子中,所有原子是否都满足最外层8电子结构?否(填"是"或"否"),其中氯元素的化合价是+4;
(2)欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半。表示这一反应的化学方程式是2NaClO3+4HCl=Cl2↑+2ClO2↑+2NaCl+2H2O
(3)我国广泛采用将经干燥空气稀释的氯气,通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,表示这一反应的化学方程式是2NaClO2+Cl2=2ClO2+2NaCl,和欧洲的方法相比,我国这一方法的主要优点是生成的ClO2中不含Cl2杂质;
(4)在酸性溶液中,用草酸钠(Na2C2O4)还原NaClO3也可制得ClO2,表示这一反应的离子方程式是2ClO3-+C2O42-+4H+=2ClO2↑+2CO2↑+2H2O,此法的优点是析出的ClO2可被CO2稀释。
25、在一条鱼、虾绝迹的小河边,如图:有甲、乙、丙、丁四座工厂,每厂排放的废液里含有纯碱溶液、FeCl3、Ca(OH)2、稀盐酸中的一种。
某中学环保小组对河水监测发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气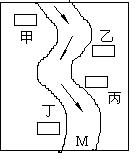
泡,河水变清。请推断:
(1)甲、乙、丙、丁四厂排放的废液里含有的污染物
依次是Ca(OH)2、FeCl3、HCl、Na2CO3;
(2)在M处取出的河水里,肯定含有的离子是
Na+、Ca2+、Fe3+、H+、Cl-及少量OH-。