高三化学综合训练●创新与实践
1.根据从草木灰中提取钾盐的实验,填写下列空白:
(1)此实验操作顺序如下:①称量样品,②溶解、沉降,③_______,④______⑤冷却结晶。
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示______(填下列正确选项的代码)。
A.左盘重,样品轻
B.左盘轻,砝码重
C.右盘重,砝码轻
D.右盘轻,样品重
(3)在进行第③步操作时,有可能要重复进行,这是由于_______
(4)在进行第④步操作时,要用玻璃棒不断小心地搅动液体,目的是防止______。
(5)所得产物中主要的钾盐有______等。
2.今有下列两组单质,试将每组单质从三个不同角度进行“分类”,每种“分类”都可分别挑出一种单质,它跟其他三种单质属于不同的“类”,将挑出的单质(写化学符号)和挑选依据(写编码)列在下面相应的表格内:
两组单质为:Ⅰ.O2、F2、S、N2Ⅱ.Fe、Na、Al、Si
“挑选依据”仅限于下述六种。该被挑出的单质跟其他三种单质不同,是由于:(A)其组成元素不属于金属(或非金属);(B)其组成元素不属于周期表中的同一族;(C)其组成元素不属于周期表中的同一周期;(D)其组成元素不属于主族(或副族)元素;(E)在常温常压下呈不同物态;(F)在常温下遇水能(或不能)放出气体。

3.A、B、C和D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种。现利用另一种溶液X,用如图所示的方法,即可将它们一一确定。试确定A、B、C、D、X各代表何种溶液:A_______,B______,C______,D______,X______。
4.写出H2S燃烧反应的化学方程式。1.0LH2S气体和aL空气混合后点燃,若反应前后气体的温度和压强都相同(20℃、101.3kPa),试讨论当a的取值范围不同时,燃烧后气体的总体积V(用含a的表达式表示。假定空气中氮气和氧气的体积比为4∶1,其他成分可忽略不计)。
答案1.(1)③过滤,④蒸发结晶(2)B(3)滤液浑浊(4)液体飞溅(5)K2CO3、K2SO4、KCl等
2.本题主要考查学生的观察能力和思维能力。首先依据题示信息,认真观察,联系单质的某些属性,结合它在周期表的位置,逐一进行类比,细心找出符合条件的组合。如第Ⅰ组里的F2,它是很活泼的非金属,能在常温常压下与水剧烈反应:2F2+2H2O=4HF+O2
而本组内O2、S、N2都不能与水反应。又如第Ⅱ组的Si,Si是非金属元素,而Fe、Na、Al都是金属。再如Fe是过渡元素,属于副族元素,位于元素周期表的第四周期,而Na、Al、Si都属于主族元素,它们都位于元素周期表的第三周期,与Fe不同。正确答案为: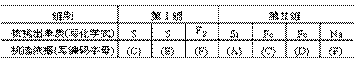
3.解题时的思维过程应为:①少量的X物质溶液分别与过量的已知四种溶液反应,有两种溶液不反应,有两种溶液产生白色沉淀。根据这四种溶液的性质,不可能产生沉淀的B、D可能是NaNO3和HNO3,而能产生沉淀的A、C可能是NaOH和Ba(NO3)2。②X与A液产生的白色沉淀,能够溶于NaNO3和HNO3中的一种B溶液,则B溶液只可能是HNO3,D溶液是NaNO3。③X与C溶液产生的白色沉淀不溶于HNO3,该沉淀只可能是BaSO4。则C是Ba(NO3)2,A是NaOH,X含SO42-。④X与过量的A(NaOH)溶液反应产生白色沉淀,则X不应含有Al3+,只可能含Mg2+,X应该是MgSO4。
正确答案:A是NaOH,B是NaNO3,C是Ba(NO3)2,D是HNO3,X是MgSO4。
4.H2S燃烧的反应方程式为
![]()
试题要计算出H2S燃烧后气体的总体积V,则在分析、讨论上述反应时,无须分清H2S燃烧时的氧化产物,只要紧盯燃烧前后气体的变化情况,从而展开讨论。
2H2S+O2=2S+2H2O ΔV1减少
2 1 3
1.0L 1.5L
2H2S+3O2=2SO2+2H2O ΔV2减少
2 3 2 3
1.0L 1.5L
(1)当a<2.5L(aL空气中含O2为0.2aL)时,空气中的O2不足,H2S燃烧只能按(Ⅰ)式反应进行,用0.2aL的O2来计算。体积减少为:0.2a×3=0.6a(L)
反应前气体总体积为(1+a)L,则
V=1+a-0.6a=(1+0.4a)L
(2)当a≥2.5(aL空气中含O2为0.2aL)时,1LH2S能够燃烧完全,不管它是完全燃烧(Ⅱ式)或不完全燃烧(Ⅰ式),反应后气体的总体积都减少1.5L(不需要再分开讨论)
∴V=(1+a)-1.5=(a-0.5)L。