高三化学综合训练●基础知识训练3
(一)单选题(每小题只有一个选项符合题意)
1.下列说法中正确的是______。
A.机动车排出的大量二氧化碳是一种大气污染物
B.酸雨的形成是由于大气中二氧化碳的含量增加引起的
C.污染空气的二氧化硫主要来源于煤和石油的燃烧
D.污染空气的二氧化硫主要来源于硫酸厂的尾气
2.下列物质不能由单质间直接反应制取的是______。
A.氯化铁
B.硫化铜
C.硫化钠
D.三氯化磷
3.下列叙述错误的是______。
A.燃烧时火焰呈黄色的一定是金属钠或钠的化合物
B.为了防止污染,不能将硫化钠溶液与稀硫酸倒入同一废液缸中
C.浓NaOH溶液应贮存于带有磨口塞的试剂瓶中
D.钠与钾的合金可作原子反应堆的导热剂
4.①钾比水轻,②钾的熔点较低,③钾与水反应时要放出热量,④钾与水反应后溶液呈碱性。某学生将一小块该金属钾投入滴有酚酞试液的水中。以上实验能证明上述四点性质中的______。
A.①④
B.①②④
C.①③④
D.①②③④
5.配制一定物质的量浓度溶液时,对所配溶液的浓度无影响的是
A.溶解固体的烧杯未洗涤
B.原容量瓶里有少许蒸馏水
C.定容时仰视液面使与刻度线相切
D.溶液配好摇匀后,发现液面低于刻度线,又加水至液面与刻度线相切。
6.下列各组物质中,分子数相同的一组是______。
A.18g水和标准状况下22.4L的三氧化硫
B.5L一氧化碳和5L二氧化碳
C.0.2mol氧气和4.48L氯气
D.标准状况下,11.2L氮气和32g二氧化硫
7.将8.0gSO3溶于92.0g水中,充分反应后所得溶液质量分数是______。
A.8.0%
B.小于8.0%
C.9.8%
D.大于9.8%
8.金属钠分别与下述溶液反应时,一定既有沉淀产生,又有气体逸出的是
A.CuSO4溶液
B.NH4NO3溶液
C.BaCl2溶液
D.Al2(SO4)3溶液
9.同一主族的X、Y、Z三种元素,已知其气态氢化物的稳定性是XH3<YH3<ZH3,则下列有关的叙述错误的是_______。
A.其最高价氧化物对应水化物的酸性强弱关系为H3XO4<H3YO4<H3ZO4
B.原子量:X>Y>Z
C.单质的熔沸点:X>Y>Z
D.原子半径:Z>Y>X
10.向K2SO4和FeCl3混合溶液中滴入Ba(OH)2溶液,当SO42-离子完全沉淀时,Fe3+也同时被完全沉淀,则原混合溶液中K2SO4和FeCl3的物质的量浓度之比为_______。
A.1∶1
B.2∶1
C.3∶2
D.3∶1
11.通常状况下将40mLH2S气体和50mLO2混合后点燃,若其中一种反应物完全消耗,则生成的SO2气体的体积是______。
A.25mL
B.30mL
C.35mL
D.50mL
12.将等体积的Na2S溶液和Na2SO3溶液混合后,滴加过量的硫酸溶液,有淡黄色沉淀产生,微热溶液,若有酸性气体产生,这说明原溶液中Na2S溶液与Na2SO3溶液的物质的量浓度是______。
A.相等
B.Na2S>Na2SO3
C.Na2S<Na2SO3
D.以上都有可能
13.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为______。
A.21∶5
B.11∶3
C.3∶1
D.4∶1
14.下列关于单质硫的性质叙述中,错误的是_______。
A.在空气中燃烧时火焰呈淡蓝色
B.通常是一种淡黄色晶体
C.微溶于水和酒精,易溶于二硫化碳
D.密度比水大
15.在下列反应中,水仅作为还原剂的是______。
A.2F2+2H2O=4HF+O2
B.SO2+H2O
![]() H2SO3
H2SO3
C.Cl2+H2O=HCl+HClO
D.2Na+2H2O=2NaOH+H2↑
(二)选择题(每小题有1~2个正确选项符合题意)
16.为了降低硫的氧化物造成的空气污染,一种方法是在含硫燃料如煤中加入生石灰,这种方法称为“钙基固硫”采用这种方法在燃烧过程中的“固硫”反应为
A.2CaO+2S=2CaS+O2
B.S+O2=SO2
C.CaO+SO2=CaSO3
D.2CaSO3+O2=2CaSO4
17.在常温下,下列物质可盛放在铁制或铝制的容器中的是
A.浓盐酸
B.硫酸铜溶液
C.稀硫酸
D.浓硫酸
18.用NA表示阿伏加德罗常数,下列说法中正确的是______。
A.24g镁与足量稀硫酸反应所失去的电子数是NA
B.16g氧气所含氧原子数是NA
C.标准状况下,22.4L甲烷和二氧化碳混合物所含的分子数是NA
D.8g氦气所含的分子是NA
19.已知某KOH样品中含水7.62%,含K2CO32.23%,含KOH90.15%。现将样品1.00g加入46.00mL1.00mol·L-1的盐酸,过量的酸用1.070mol·L-1的KOH溶液中和,蒸发到无水时,可得的固体的质量为_______。
A.3.00g
B.3.43g
C.4.50g
D.无法计算
20.下列物质在空气中久置变质,在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是______。
A.漂白粉
B.食盐
C.氯水
D.绿矾
21.下列反应的离子方程式错误的是______。
A.碳酸钙与盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
B.将SO2气体通入溴水中:SO2+Br2+2H2O=2HBr+SO42-+2H+
C.在漂白粉水溶液中通入SO2气体:
Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.碳酸氢钠溶液与NaOH溶液反应:HCO3-+OH-=CO32-+H2O
22.重水A和普通水B分别跟足量的金属钠反应,下列叙述正确的是
A.A、B质量相等时,产生气体的体积在同温同压下相等
B.A、B质量相等时,产生气体的质量相等
C.A、B的物质的量相等时,产生气体的体积在同温同压下相等
D.A、B的物质的量相等时,产生气体的质量相等
23.在3BrF3+5H2O=HBrO3+Br2+9HF+O2的反应中,氧化产物与还原产物的物质的量之比为______。
A.1∶2
B.2∶1
C.3∶5
D.5∶3
24.在等物质的量的短周期金属元素单质A和B中,分别加入足量的酸,在A中加入盐酸,在B中加入稀硫酸,反应完全后,生成氢气的体积分别为X(A)和Y(B),而且X(A)≠Y(B),若要确定反应生成物中A和B的化合价,至少还需要知道的数据是______。
A.X(A)∶Y(B)的值
B.X(A)[或Y(B)]的值
C.A(或B)的物质的量
D.HCl和H2SO4的物质的量浓度
25.氰气的化学式为(CN)2其化学性质与卤素相似,下列叙述中正确的是
A.1mol氰气含有2mol原子
B.氰气能跟水发生反应
C.氰化钠和氰化银都不溶于水
D.(CN)2可与氢氧化钾溶液反应
(三)填空题
26.A元素原子有3个电子层,最外层上有6个电子,B元素原子比A元素原子少5个电子。
(1)B元素的原子结构示意图是______。
(2)A、B两元素形成的化合物的化学式是______。
(3)A元素形成的氢化物常温下与它的一种气态氧化物发生反应的化学方程式是______,当有1.5mol氧化物参加反应时,共______个电子发生转移,该反应氧化产物与还原产物的质量比是______。
27.有一包白色粉末,其中含有氯化钠、碘化钾、碳酸钠、无水硫酸铜、氯化钡中的一种或几种,取粉末试样,进行下述实验。
(1)溶于蒸馏水得到无色溶液和白色沉淀。
(2)在溶液中滴入硝酸银溶液,又产生夹带白色的黄色沉淀
(3)在(2)沉淀中滴入稀硝酸,沉淀部分溶解并产生无色无臭气体。由此推断,粉末中一定含有的物质是______;一定不存在的物质是______;可能存在的物质是_______。
28.在标准状况下有①6.72LCH4;②3.01×1023个HCl分子;③13.6g硫化氢;④0.2mol氨气,将下列各项用序号标出从大到小的顺序。
(1)体积______;(2)密度_______;
(3)质量______;(4)含氢原子个数______。
29.将以下各项内容中浓H2SO4所起的作用或表现出的性质及有关化学方程式填写在空格里。
(1)浓H2SO4与木炭加热反应,表现的性质是______,有关化学方程式为______。
(2)浓H2SO4敞口放置在空气中,质量增加,表现的性质是______。
30.下面是四种盐在不同温度下的溶解度(g/100gH2O)
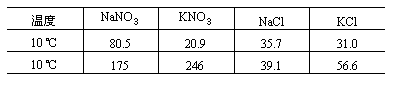
(假设:①盐类共存时不影响各自的溶解度。②分离晶体时,溶剂的损耗忽略不计。)
某同学设计用物质的量比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如图:
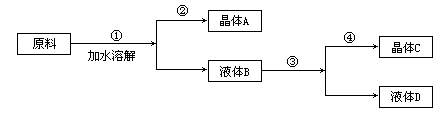
(1)在①和③的实验过程中,关键的实验条件是_______。
(2)分离出晶体的②和④的操作是______(填“倾倒”、“蒸发”、“结晶”、“过滤”中的某种操作)。硝酸钾是晶体_______(A或C)
(3)粗产品中可能含有的杂质离子是______;检验的方法是______。
(4)欲将粗产品提纯,可采取的方法是______。
31.在容量瓶的使用方法中,下列操作不正确的是______(填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,须用量筒量取试样后,直接倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管滴加蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次。
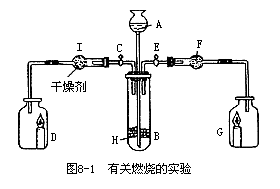
32.为证明有关物质的性质,某学生设计了如图8-1所示的装置,当打开活塞C,使液体A与搁板H上的固体B相遇时,即有气体产生,并发现D中蜡烛(含C20~30的烷烃)慢慢熄灭;关闭C打开E时,则看到G中蜡烛燃得更亮,请写出该装置中有关仪器内盛放的物质:A.______,B______,F_______,用化学方程式表示上述实验中发生的有关反应(设蜡烛的化学式为CxHy)
__________ __________
__________ __________
(四)计算题
33.将浓度为a%的NaOH溶液蒸发掉mg水后,变成2a%的NaOH不饱和溶液VmL。求所得NaOH溶液的物质的量浓度。
34.将100.0mL、1.25mol·L-1的盐酸逐滴加入到100.0mL、1.00mol·L-1的碳酸溶液中。求在标准状况下能收集到CO2气体的体积(已知标准状况下CO2饱和水溶液的浓度为0.04mol·L-1)。
答案(一)单选题(二)选择题
(三)填空题
26.(1) ![]() (2)Na2S(3)2H2S+SO2=3S+2H2O;6NA;2∶1
(2)Na2S(3)2H2S+SO2=3S+2H2O;6NA;2∶1
27(1)碘化钾,碳酸钠,氯化钡;(2)无水硫酸铜;(3)氯化钠;
28.(1)②③①④(2)②③④①(3)②③①④(4)①③④②
29.强氧化性,C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O,吸水性
CO2↑+2SO2↑+2H2O,吸水性
30.(1)温度(2)过滤;C(3)Na+和Cl-;用铂丝蘸取滤液在酒精灯火焰上灼烧,火焰显黄色,说明含Na+。另取滤液少许加入硝酸银溶液和稀硝酸,有白色沉淀生成,且不溶于稀硝酸,说明含Cl(4)重结晶
31.B、C、D
32.稀盐酸;CaCO3;Na2O2;
CaCO3+2HCl=CaCl2+H2O+CO2↑
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑
![]()
(四)计算题
33.原溶液为2mg,含NaOH:
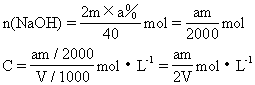
34.反应分两步:
Ⅰ.Na2CO3+HCl=NaHCO3+NaCl
Ⅱ.NaHCO3+HCl=NaCl+CO2↑+H2O
n(CO2总)=n(HCl)-n(Na2CO3)
=1.25mol·L-1×0.10L-1.00mol·L-1×0.10L=0.025mol
n(溶解CO2)=0.04mol·L-1×(0.100+0.100)L=0.008mol
V(CO2)=(0.025-0.008)mol×22.4L·mol-1=0.381L
答:产生CO2为381mL。