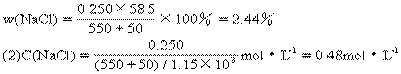高三化学综合训练●综合能力训练2
(一)选择题
1.熟石膏的化学式是______。
A.2CaSO4·H2O B.CaSO4·2H2O C.CaSO4·H2O D.CaSO4
2.质量相等的石墨与足球烯(C60)所含质子数______
A.前者多 B.后者多 C.相等 D.无法确定
3.通常情况下,能大量共存,并且都能用浓硫酸干燥的一组气体是______。
A.SO2、O2、H2S B.HCl、CO2、N2 C.CO、H2S、H2 D.HBr、N2、Cl2
4.下列物质中,同时含有氯分子、氯离子和氯的含氧化合物的是______。
A.液氯 B.次氯酸 C.氯水 D.次氯酸钙
5.某同学用托盘天平称量固体药品时,称量前指针未调零点。天平平衡时用了10g砝码,游码指示0.5g,则药品的真实质量是______。
A.大于10.5g B.小于10.5g C.等于10.5g D.无法确定
6.钡和钠相似,也能形成含O22-离子的过氧化物,下列叙述中正确的是
A.过氧化钡的化学式是Ba2O2
B.1mol过氧化钠或过氧化钡跟足量水反应都生成0.5mol氧气
![]()
D.过氧化钠或过氧化钡都是强氧化剂
7.最近医学界通过用放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关14C的叙述正确的是______。
A.与C60中普通碳原子的化学性质不同 B.与14N含的中子数相同
C.是C60的同素异形体 D.与12C互为同位素
8.科学家预言,114号元素具有稳定的同位素,关于它的结构和性质预测,错误的是______。
A.它的原子最外层上有4个电子 B.它的金属性比铅强
C.它的密度比铅大 D.它的主要化合价有+2价和+4价,且+4价化合物最稳定
9.下列实验中,不生成黑色固体物质的是______。
A.铁丝在氧气中燃烧 B.日光照射溴化银
C.细铜丝在硫蒸气中燃烧 D.细铜丝在氯气中燃烧
10.在做从草木灰中提取钾盐的实验操作(与粗盐提纯相似)时,在溶解、过滤、蒸发操作中,都要用到的仪器是_______。
A.玻璃棒 B.漏斗 C.烧杯 D.蒸发皿

A.KCl、Na2SO4 B.NaCl、K2SO4 C.NaCl、Na2SO4、K2SO4 D.KCl、Na2SO4、K2SO4
12.将溶质的质量分数为a%,物质的量浓度C1mol·L-1的稀硫酸蒸发掉一定量的水,使其溶质的质量分数为2a%,此时物质的量浓度为C2mol·L-1,则C1与C2的关系是______。
A.C2=2C1 B.C2<2C2 C.C2>2C1 D.C1=2C2
13.将30℃时物质A的溶液136g分成两等份,向其中一份中加入10gA,结果只溶解2g就不再溶解;将另一份溶液降温至0℃,析出A5.5g,此时溶质的质量分数为20%,A在30℃时的溶解度为______。
A.20g B.30g C.40g D.50g
14.将如下卤化物跟浓硫酸放在烧瓶中共热,可以得到纯净的卤化氢气体的是______。
A.NaFB.NaClC.NaBrD.NaI
15.将一定量的钠、铝合金置于水中,合金全部溶解,得到20mL、pH=14的溶液。然后用1mol·L-1的盐酸滴定至沉淀量最大时,消耗盐酸40mL。原合金中钠的质量为_______。
A.0.92gB.0.69gC.0.46gD.0.23g
16.下列离子在溶液中可以大量共存的是______。
A.Cl-、Cu2+、H+、MnO4-B.NO3-、K+、OH-、Ba2+
C.SO42-、SO32-、Na+、CO32-D.S2-、SO32-、Na+、H+
17.下列两种液体,可用分液漏斗分离的是_______。
A.酒精和水B.液溴和汽油C.水和四氯化碳D.碘水和溴水
18.向盛有氯化钡稀溶液的甲、乙两试管中分别通入SO2至饱和,若向甲试管中加入足量硝酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是_______。
A.两试管都有白色沉淀生成B.甲试管有白色沉淀,乙试管没有
C.两试管都没有白色沉淀生成D.甲试管没有白色沉淀,乙试管有
19.mg铜和含nmol硫酸的浓硫酸反应,得到二氧化硫气体VL(标准状况下测定),则被还原的硫酸是______。
A.m/64molB.n/2molC.nmolD.V/22.4mol
20.在一定条件下,KI、Zn、FeBr2分别与足量的Cl2反应,如果3个反应得失电子数目相等,则KI、Zn、FeBr2的物质的量之比为______。
A.1∶2∶3B.3∶2∶1C.6∶3∶2D.2∶3∶6
21.向密度为dg·cm-3的盐酸中,逐滴加入硝酸银溶液到过量,生成沉淀的质量与原盐酸的质量相等,原盐酸的物质的量浓度为(mol·L-1)_______。
A.25.4dB.12.7dC.6.97dD.6.35d
22.合乎实际,并用于工业生产的是_______。
A.金属钠在氯气中燃烧制氯化钠B.氢气和氯气混合后经光照制氯化氢
C.氯气和石灰水作用制漂白粉D.浓硫酸和萤石在铅制容器中作用制氟化氢
23.在氧气中燃烧镁和另一种金属组成的合金,当形成的化合物的质量是反应前镁合金的质量的1.3倍,合金中另一种金属是_______。
A.NaB.BaC.AlD.Fe
24.质量分数相等的Na2CO3和NaHCO3的混合物ag,加热一段时间后质量变为bg。当NaHCO3完全分解时b值是_______。

25.将m1g锌加到m2g20%的盐酸中去,反应结果共放出nL氢气(标准状态),则被还原的HCl的物质的量是______。
26.将40℃的饱和石灰水冷却至10℃,或加入少量CaO,但温度仍保持40℃,这两种情况下均不改的是______。
A.Ca(OH)2的溶解度B.溶液中溶质的质量分数C.溶液的质量D.溶液中Ca2+的数目
(二)填空题
27.已知实验室可通过下列反应制取硫化氢(实验室制备H2S装置与制CO2相似)气体:FeS+H2SO4(稀)=FeSO4+H2S↑。为验证二氧化硫既有还原性又有氧化性,请用下面的试剂和图8-2的仪器进行实验。可选用试剂有:①盐酸,②溴水,③亚硫酸钠固体,④硫化亚铁固体,⑤品红试液,⑥氢氧化钠溶液,⑦浓硫酸。可选用的仪器装置如图所示:(1)按二氧化硫气流方向,用橡皮管(图中未画出)连接上述仪器,正确的连接顺序是(用导管口序号填空):______接______,______接______(或______)。
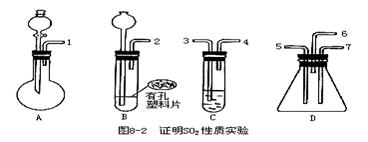
(2)在装置A、B、C中应加入试剂是(用试剂名称填空):A______,B______,C______。
(3)表现二氧化硫氧化性实验所用的是上述装置中的______,实验中观察到的现象是______;表现二氧化硫的还原性实验所用的是上述装置中的______,实验中观察到的现象是______,其反应的离子方程式是______。
(4)整套装置最后气体出口导管应连接______装置,这样处理的原因是______。
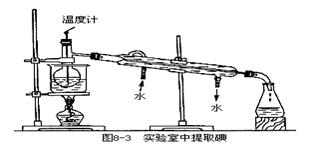
28.海藻中含有丰富的碘元素(以Ⅰ-形式存在)。实验室中提取碘的流程
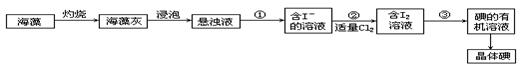
(1)在虚线框内画出实验操作①的仪器装置示意图。实验操作③的名称是______,所用主要仪器名称为______。
(2)提取碘的过程中,可供选择的有机试剂是______(填序号,多选扣分)。
A.酒精(沸点78℃)B.四氯化碳(沸点77℃)C.氯化钠溶液D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消除此杂质,使碘全部游离出来,应加入适量(填序号)______溶液,反应的离子方程式为______。
A.KIO3B.HClOC.KID.Br2
(4)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如图8-3所示)。请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充)。①______②③④_______
(5)实验中使用水浴加热的原因是______,最后晶体碘聚集在______(填仪器名称)中。
29.在一烧杯中盛有100mL、2mol·L-1的H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图8-4所示)。向该烧杯里缓缓注入0.4mol.L-1的Ba(OH)2溶液至恰好完全反应,在此实验过程中
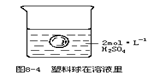
(1) 烧杯里观察到的实验现象有:①______;②______。
(2)写出实验过程中反应的离子方程式______。
30.在已经提取了NaCl、MgBr2等化学物质的富碘卤水中,采用如下工艺流程生产碘单质:
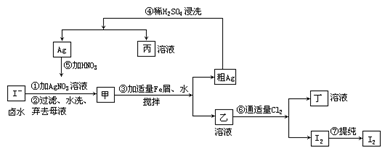
(1)乙、丁中溶质的分子式:乙______,丁______。
(2)第④步操作中用稀H2SO4浸洗的目的是______(填编号)。
A.除去未反应的NO3-B.除去未反应的I-C.除去未反应的FeD.除去碱性物质
(3)第①步操作可供提纯I2的两种方法是______。
(4)甲物质见光易变黑,其原因是(用化学方程式表示):_______。
(5)反应⑤中所加的HNO3应选(填“稀、浓”)______硝酸,原因是______。
(三)计算题
31.在常温常压下100mLH2S和O2的混合气体,在点燃条件下充分反应(O2完全反应),恢复到原状态时剩余25mL气体,求原混合气体中H2S和O2各为多少毫升?
32.由Fe2O3、CuO组成的混合物32g溶于200mL稀硫酸溶液中,然后加入4mol·L-1NaOH溶液,开始无沉淀生成,随着NaOH溶液的加入,沉淀量增多,当加入300mLNaOH溶液时恰好沉淀完全,求原稀硫酸溶液的物质的量浓度是多少?
33.50.0g20.0%的NaOH溶液和0.500mol·L-1的HCl溶液(密度为1.10g·cm-3)550g恰好完全中和生成密度为1.15g·cm-3的NaCl溶液。计算:
(1)NaCl溶液的质量分数。
(2)NaCl溶液物质的量浓度。
答案
(一)选择题

(二)填空题
27.(1)1接3,4接5(2)Na2SO3和浓硫酸,盐酸和硫化亚铁;溴水(3)D;瓶壁上有淡黄色固体析出,同时有水珠生成;C;溴水橙色褪去,变成无色。SO2+Br2+2H2O=4H++SO42-+2Br-(4)用NaOH溶液吸收尾气;尾气中的H2S、SO2都有毒,用NaOH溶液吸收,防止污染空气。
28(1)如图2。萃取,分液漏斗。(2)B、D(3)C,I-+Icl=Cl-+I2(4)①缺石棉网②温度计的水银球应在蒸馏烧瓶的支嘴部位③冷凝管的进、出水的方向错了。(5)溶剂沸点较低,控制温度不过高,避免I2进入冷凝管;蒸馏烧瓶。
29.稀硫酸溶液的密度比水的密度大。
(1)溶液里有白色沉淀生成;小球沉在烧杯底部;
(2)Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
30.(1)FeI2;FeCl3(2)C(3)萃取;升华。
![]()
(5)稀;氧化同质量的银,用稀硝酸,消耗的HNO3的物质的量少。
(三)计算题
31.(1)若剩余25mL气体是H2S。设原O2的体积为x。
2H2S+O2=2S+2H2O 气减少
2 1 3
x (100-25)mL
x=(100-25)/3=25mL
O2为25mL,H2S为75mL(2)若剩余气体是SO2,设原混合气体中H2S的体积为y。
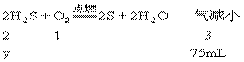
y=2×75/3=50mL
因为S+O2
![]() SO2气体的体积不变,H2S为50mL,O2为50mL
SO2气体的体积不变,H2S为50mL,O2为50mL
32.解:有关化学方程式为:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+H2SO4=CuSO4+H2O
H2SO4+2NaOH=Na2SO4+2H2O
Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
可知:硫酸最终转化为Na2SO4
设硫酸物质的量浓度为x
相当式2NaOH~Na2SO4~H2SO4
2mol 1mol
4×0.3mol 0.2xL
x=4×0.3/2×0.2mol·L-1=3mol·L-1
答:硫酸溶液的物质的量浓度为3mol·L-1。
33.(1)n(NaCl)=n(NaOH)=50.0×0.2/40mol=0.250mol