高三联考化学试卷
可能用到的相对原子质量:H:1 Na:23 Mg:24 Fe:56 K:39 Cu:64 C:12 O:16 S:32 Cl:35.5
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个正确答案)
1.下列说法正确的是
A.水分子是由两个氢元素和一个氧元素组成
B.在化合物中,元素的化合价的数值就是原子得失电子的数目,失去电子为正价,获得电子为负价
C.一个过氧化氢分子中含有两个氢原子和两个氧原子
D.能电离出H+和酸根离子的物质一定是酸
根据下表提供的材料,回答2、3题。
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
2.若对应于上述离子方程式的电子转移总数为10,则反应物、生成物的组序号是
A.②和④ B.只有② C.只有④ D.只有③
3.下列叙述中,正确的是
A.表中第①组反应的氧化产物只有FeCl3(实为Fe3+)
B.氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较:H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数应为16
4.有关叙述:①非金属单质M能从N的化合物中置换出非金属单质N。②M原子比N原子容易得到电子。③单质M跟H2反应比N跟H2反应容易得多。④气态氢化物水溶液的酸性HmM>HnN。⑤氧化物水化物的酸性HmMOx>HnNOy。⑥熔点M>N。能说明M比N的非金属性强的叙述是
A.①②③ B.②③⑤ C.①②④⑤ D.全部
5.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是
A.该粒子不显电性 B.该粒子质量数为4
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大
6.下列离子方程式中正确的是
A、过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C、硫化钠溶于水中:S2-+2H2O=H2S↑+2OH-
D、FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
7.在体积可变的密闭容器中建立氨气在水中的溶解平衡和电离平衡,在右图的容器中按图示操作,下列各项叙述正确的是
 A.氨水的浓度增大,pH减小
A.氨水的浓度增大,pH减小
B.液面上氨气的压强增大,水溶液的pH不变
C.液面上氨气的压强不变,溶液的浓度增大,pH变大
D.液面上氨气的压强变大,溶液的浓度增大,NH3·H2O电离度变大
8.咖喱是一种烹饪辅料,若沾到白色衬衣上,用普通肥皂清洗,黄色污渍变成红色,经水漂洗后红色又恢复到黄色,据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用
A.品红溶液 B.石蕊试液
C.氯水 D.KI-淀粉液
9.电解KOH溶液时,若阴、阳两极分别为碳和铁,当生成0.1mol Fe(OH)3沉淀时,共消耗amol H2O,产生bLH2(标准状况).则a和b分别为
A.a=0.25,b=2.24; B.a=0.05,b=2.24;
C.a=0.25,b=4.48; D.a=0.3,b=3.36.
10.某酸的酸式盐NaHY在水溶液中,HY-的电离度小于HY-的水解程度。有关叙述中正确的是
(A)H2Y在电离时为:H2Y+H2O![]() HY-+H3O+
HY-+H3O+
(B)在该盐的溶液中,离子浓度为:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
(C)在该盐的溶液中,离子浓度为:[Na+]>[HY-]>[Y2-]>[OH-]>[H+]
(D)HY-水解方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
11. 当25 ℃时,在下列相同摩尔浓度的溶液中,水的电离度由大到小排列正确的是
① KNO3 ② NaOH ③ NaCl ④ (NH4)2SO4
(A) ②>④>①=③ (B) ④>①=③>②
(C) ①=③>④>② (D) ④>②>①=③
12.已知t℃时,M克某物质溶液中含溶质n克。将该液蒸发P克水,恢复至t℃时析出a克晶体;若原溶液蒸发Q克水(Q>P),恢复至t℃时析出b克晶体(晶体均不含结晶水)。该物质在t℃时溶解度为
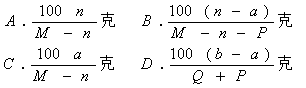 |
13. 在25℃时,pH值等于11的NaOH溶液和NaCN溶液,两溶液中水的电离度大小的比较正确的是
A. 相等 B. 后者比前者大11倍 C. 后者是前者![]() 倍
D. 前者是后者
倍
D. 前者是后者![]() 倍
倍
14.有A、B、C三种单质,在一定条件下A与B化合成D,B与C化合成E,A与C化合成F,F在足量空气中燃烧生成D和E,则D、E、F三种物质分别是:
A.Na2O、H2O、NaOH B.NO2、H2O、NH3 C.H2O、SO2、H2S D.CO、H2O、CH4
15.有些固体药品长期存放时,若因密封不严,则瓶内会逐渐积聚一定量液体,以下各组中的每种药品都有可能出现这种现象的一组是:
A.无水硫酸铜,生石灰,烧碱
B.红磷、烧碱、无水氯化钙
C.纯碱,芒硝,熟石灰
D.氯化镁,明矾,氯化钠
二、非选择题(共55分)
16.(7分)在0.5mol·L-1:纯碱溶液中滴入酚酞试液变红,若在该溶液中再逐滴滴入过量
BaCl2溶液,所观察到的现象是;其原因是(用离子反应方程式和简要文字说明):
_________________________________________________________
_________________________________________________________
17.(8分)在一个容积为5L的密闭容器中,充入NH3和O2,它们的摩尔比为1∶2,发生如下反应:4NH3+5O2![]() 4NO+6H2O(气)
4NO+6H2O(气)
(1)上述反应在一定条件下2min后达到平衡,NH3为2mol,NH3的转化率为20%,以NO的浓度变化表示该反应的平均速度为 ,O2的平衡浓度为 .
(2)在达到平衡后,加入相当于原组成气体1倍的惰性气体,如果容器的体积不变,平衡 移动;如果总压强保持不变,平衡又 移动.
18.(12分)从化合物A出发,发生下图所示的一系列变化:
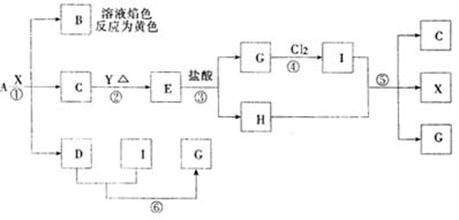 |
已知:A是由三种短周期元素组成的固体化合物,C为浅黄色固体,D、H为无色气体,E为黑色固体,G为浅绿色溶液,I为棕黄色溶液,X为液体,Y为某金属,试回答:
(1)写出有关物质的分子式:A是__________E是__________X是__________
(2)写出有关反应的离子方程式:
①______________________
⑤______________________
⑥______________________
19.(9分)、不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成分为带负电荷的一方。
下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.25 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1) 通过分析x值变化规律,确定Mg、N的x值范围:
<x(Mg)< , <x(N)< 。
(2)推测x值与原子半径的关系是 。据据短周期元素的x值变化特点,体现了元素性质的 变化规律。
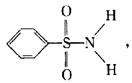
(3)某有机化合物结构式为: 其中S—N键中你认
为共用电子对偏向谁? (写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx<1.7,一般为共价键,试推断:AlBr3中化学键类型是 。
(5)预测元素周期表中,x值最小的元素的位置: (放射性元素除外)。
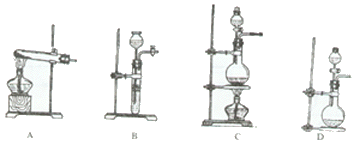
20.(10分)现有化学试剂:NH4Cl浓溶液、生石灰及常用干燥剂,制取干燥,纯净的氨气。
(1)请从下面的仪器中选择制取氨气的发生装置。(要求使用仪器最少、合理。) (写序号)
(2)写出用NH4Cl浓溶液与生石灰反应制取氨气的理由。
(3)实验操作时,关键之处是
理由是
(4)干燥氨气应选用的干燥剂是
21.(9分) 向某二价金属M的氢氧化物溶液中加入过量的NaHCO![]() 溶液,反应后生成该二价金属的碳酸盐,过滤后得沉淀物39.4克。此沉淀溶于足量盐酸中,生成的气体在标准状况下为4.48升。取滤液的
溶液,反应后生成该二价金属的碳酸盐,过滤后得沉淀物39.4克。此沉淀溶于足量盐酸中,生成的气体在标准状况下为4.48升。取滤液的![]() 升,恰与70毫升1摩/尔的盐酸完全反应,得到气体1.12升(标准状况)。
升,恰与70毫升1摩/尔的盐酸完全反应,得到气体1.12升(标准状况)。
试计算:(1) 沉淀物的物质的量。
(2) 金属M的原子量。
(3) 最初加入的NaHCO![]() 的质量
的质量
化学试题参考答案:
一、选择题(3分×15=45分)
1.C 2.A 3.D 4.A 5.C 6.A 7.B 8.B 9.A 10.A 11.B 12.B 13.C 14.C 15.B
二、非选择题(共55分)
16.(共5分) (1)生成白色沉淀,红色消失(2分,每个现象得1分)
(2)Ba2++CO32-=BaCO3↓,CO32-浓度减少,使平衡CO32-+H2O ![]() HCO3-+OH-向逆反应方向移动,C(CO32-)减少趋近于10-7mol·L-1
(3分)
HCO3-+OH-向逆反应方向移动,C(CO32-)减少趋近于10-7mol·L-1
(3分)
17.(1)0.05mol/L.min;0.875 mol/L
(2)不;向正反应方向
18.(1)A是Na2S2O3 E是FeS X是HCl
(2)①S2O32-+2H+===S↓+SO2+H2O
⑤2Fe3++H2S===2Fe2++S↓+2H+
⑥SO2+2Fe3++2H2O====SO42-+2Fe2++4H+
19.(1)0.93-1.57 (2)2.25-3.44
(2)X越大,原子半径越小, 周期性
(3)氮
(4)共价键
(5)六-IA
20.(10分)(1)D(2分)
(2)生石灰遇水生成氢氧化钙并放热,氢氧化钙和氯化铵受热生成氨气,或(CaO+H2O![]() Ca(OH)2,放热反应,Ca(OH)2+2NH4Cl
Ca(OH)2,放热反应,Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O)(3分)
CaCl2+2NH3↑+2H2O)(3分)
(3)将NH4Cl浓溶液逐滴滴加到生石灰中(2分)生石灰充分吸收水,在水较少条件下反应易发生NH3气易生成(2分)
(4)碱石灰或NaOH晶体(1分)
21.〖解答〗
(1) M(OH)2 + 2NaHCO3 = MCO3↓+ Na2CO3 + H2O
(2) MCO3 + 2HCl = MCl2 + H2O + CO2↑
沉淀物的物质的量0.2 mol。
金属M的原子量 197 - 60 = 137.
NaHCO3 共 0.2 + 0.05×10 = 0.7 摩尔,即 58.8 克。
22. 分析 本题为分别测定10g混气中SO2、CH4、CO2和H2的质量分数,由各自的性质和所给装置及试剂可知KMnO4吸收SO2,Ba(OH)2吸收CO2,CuO与CH4和H2反应通过⑤的增重而测定CH4和H2,故干燥吸收SO2和CO2后的余气可使CH4和H2的质量分数不受影响。②质量减少为O原子,⑤质量增加为生成的CO2和H2O
设 甲烷为x mol,H2为y mol,则
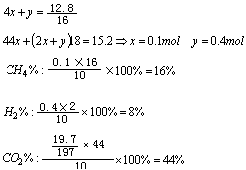
答案 (1)③④①②⑤;(2)偏大偏小;(3)16% 44%