高三年级测试化学试题
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Cl—35.5 Fe—56
Cu—64 Zn—65
一、选择题:(每小题只有一个符合题意的选项,每小题3分,共15分。)
1、室温下,等体积的0.5mol/L的下列物质的溶液:(1)KCl ;(2)HF;(3)FeCl3 ;(4)Na2CO3中所含阳离子数由多到少的顺序是
A、(4)>(1)=(2)>(3) B、(1)>(4)>(2)>(3)
C、(4) >(3)>(1) >(2) D、(3)>(2)>(1)>(4)
2、常见的永久磁铁BaFe12O19和曾用于雷达微波过滤器里的钇铁榴石Y3Fe5O12均为铁氧体,它们所含铁元素的价态是
A、均为+2 B、均为+3价 C、分别为+2和+3价 D、分别为+3和+2价
3、下列分子中所有原子都满足最外层8个电子结构的是
A、BBr3 B、二氟化氙 C、乙醇 D、氟里昂(CCl2F2)
4、L—多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
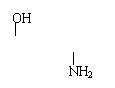 |
HO——CH2CHCOOH
这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖研究成果,下列关于L—多巴酸碱性的叙述正确的是
A、既没有酸性,又没有碱性 B、既具有酸性,又具有碱性
C、只有酸性,没有碱性 D、只有碱性,没有酸性
5、冬季所用的护肤品的有效成分称为保湿因子,其主要作用是使皮肤上附着一层吸水和保水的物质,因而感觉舒适不干燥,下列物质中有可能被采用的是
![]()
![]()
 A、CH3OH B、C2H5OH C、CH2—CH—CH2 D、[CH2—CH]n
A、CH3OH B、C2H5OH C、CH2—CH—CH2 D、[CH2—CH]n
二、选择题:(每小题可能有一个或两个符合题意的选项,每小题3分,共36分)
6、人体正常的血红蛋白中含有亚铁离子,若误食亚硝酸盐,则导致血红蛋白中的亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸盐中毒,下列叙述正确的是
A、亚硝酸盐是还原剂 B、维生素C是还原剂
C、维生素C能把亚铁离子氧化成三价铁离子 D、亚硝酸盐被氧化
7、已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是
A、BeCl2溶液的PH<7,将其蒸干并灼烧后得到的残留物可能是BeO
B、Na2BeO2溶液的PH>7,将其蒸干并灼烧后得到的残留物为BeO
C、Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D、BeCl2水溶液的导电性强,故BeCl2是离子化合物
8、在一个固定体积的密闭容器中,保持一定温度,进行如下反应:H2(g)+Br2(g)2HBr(g),已知加入1mol H2和2mol Br2时,达到平衡,生成amol HBr。在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x,y,z(均不为零),如果仍保持平衡时各组分的百分含量不变,以下推断不正确的是
A、x,y,z应满足的关系是y=2x B、x,y,z应满足的关系是4x+z=2y
C、达平衡时,HBr的物质的量为![]()
D、达平衡时,HBr物质的量一定仍为amol
9、PH=3的二元弱酸H2R溶液与VL PH=11的NaOH溶液混合后,混合液呈中性,下列判断正确的是
A、溶液总体积为2VL B、溶液中:2c (R2-) + c (HR—) = C (Na+)
C、溶液中:c (R2-) > c (Na+) > c (HR—) D、溶液中:c (R2—)+c(OH—)=c(Na+)+c(H+)
10、一定质量的Cu与足量的浓HNO3或稀HNO3完全反应,在相同条件下用排水法收集反应产生的气体(浓稀HNO3的还原产物分别为NO2和NO),下列叙述正确的是
A、浓HNO3的反应速率大 B、浓HNO3消耗的HNO3少
C、浓HNO3产生的气体少 D、两者排水法收集到气体的体积相等
11、近年来,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是
A、硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B、硅的来源丰富,易于开采,且可再生
C、硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D、寻找高效催化剂,使SiO2分解产生硅同时释放能量,是硅能源大规模开发利用的一项关键技术
12、熔融盐燃料电池具有高的发电效率,因而受到重视。某该种电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,用CO、空气、CO2作为燃气,制得在6500C下工作的燃料电池。两极反应为
2CO+2![]() —4e—= 4CO2
O2+2CO2+4e— = 2
—4e—= 4CO2
O2+2CO2+4e— = 2![]()
下列有关该电池的判断不正确的是
A、电池总的反应式为2CO+O2 = 2CO2
B、CO在负极上被氧化
C、放电时,电池中CO2气体的总量会减少
D、该电池的工作原理可说明Li2CO3的热稳定性较好
13、用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A、c (H+) 和 c (OH—)的乘积 B、溶液的PH值
![]() C、一水合氨的电离程度
D、c (NH3·H2O) c (OH—)
C、一水合氨的电离程度
D、c (NH3·H2O) c (OH—)
14、1999年曾报道合成和分离出含高能量正离子N5+的化合物N5AsF6,下列有关此化合物叙述错误的是
A、N5+共有34个核外电子
B、N5+中氮原子间以共用电子对结合
C、化合物N5AsF6中As的化合物价为+3
D、化合物N5AsF6中F的化合价为—1
15、200C时,将某盐R的溶液蒸发掉10g水后,恢复到200C,需再加入8g盐R(无水)溶液即达饱和。若先加入2克盐R后再将盐溶液蒸发掉30克水恢复到200C也达饱和。200C时盐R的溶解度(g)是
A、20克 B、25克 C、30克 D、60克
16、相同体积的容器分别抽成真空后,再充入下列气体的混合物,常温下,最终容器内气体的压强大小顺序为
(1)2mol HCl和2mol NH3 (2)2mol NO和2mol O2
(3)2mol H2S和 2molSO2 (4)2mol H2和1mol Cl2
A、(4)=(2)>(3)>(1) B、(1)=(2)=(3)>(4)
C、(4)>(2)>(3)>(1) D、(3)>(2)=(4)>(1)
17、可逆反应:3X(g)3Y(?)+Z(?);△H>0,随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
A、Y和Z可能都是固体 B、Y和Z一定都是气体
C、若Z为固体,则Y一定是气体 D、Y和Z可能都是气体
三、选择题:(每小题只有一个符合题意的选项,每小题4分,共32分)
18、2001年闹得沸沸扬的“毒粉丝事件”,是粉丝中掺入吊白块。吊白块学名为甲醛次硫酸氢钠,它能使粉丝漂白,但在粉丝中残留甲醛等有毒物质,严重危害人体健康。它可由NaHSO3和HCHO在一定条件下反应制得:NaHSO3+HCHO→NaO—CH2—SO3H该反应的类型是
A、取代反应 B、加成反应 C、聚合反应 D、消去反应
19、某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42—的物质的量浓度为6mol/L,则此溶液中还可溶解铁粉
A、11.2g B、16.8g C、19.6g D、22.4g
20、R2O8n—在一定条件下可以把Mn2+氧化成MnO4—,自己则完全转变成RO42—,又知该反应中氧化剂还原剂的物质的量之比为5 :2,则n 值为
 A、1 B、2 C、3 D、4
A、1 B、2 C、3 D、4
21、如图所示的两个装置中,溶液的体积均为
200mL,开始时电解质溶液的浓度均为0.1mol/L,工
作一段时间后,测得导线上通过0.02mol电子,若不
考虑盐的水解和溶液的体积变化,则下列叙述正确的是
A、产生气体的体积(1)>(2)
B、电极上析出固体物质的质量(1)>(2)
C、溶液PH变化(1)增大,(2)减小
D、电极反应式:(1)中阳极:4OH——4e— = 2H2O+O2↑
(2)中负极:2H++2e—=H2↑
22、加热25gA,5gB,10gC的混合物,使之充分反应,所得混合物中含有10gA,21gC,还有另一种物质D,假设A、B、C、D代表反应物或生成物的化学式,并令它们的式量依次是30,20,44,18,则反应的化学方程式是
A、2A+B=C+2D B、A+2B=2C+D C、2A+B=2C+D D、A+2B=C+2D
23、14gCu、Ag合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况)O2混合,恰好被水全部吸收生成硝酸,则金属中Cu的质量为
A、1.6g B、3.2g C、6.4g D、9.6g
 24、工业上用以合成氨的原料之一 ——氢气,有一种来源是取自石油气。例如丙
24、工业上用以合成氨的原料之一 ——氢气,有一种来源是取自石油气。例如丙
烷,有人设计了以下反应途径:(1)C3H8 3C+4H2 ; (2)C3H8 C3H6
+H2 ;(3)C3H8+3H2O 3CO+7H2 ;(4)C3H8+5O2 → 3CO2+4H2O ,
2H2O 2H2↑+O2↑。假设反应都能进行,请你判断出最合理的途径,利用该途径,理论上用1mol丙烷最多可制得氨
A、4mol B、6.7mol C、10mol D、2.7mol
25、某二价金属碳酸盐和酸式碳酸盐的混合物跟足量的盐酸反应,消耗H+和产生的CO2的物质的量之比为6 :5,该混合物中碳酸盐和酸式碳酸盐的物质的量之比为
A、1 :1 B、1 :2 C、1 :3 D、1 :4
四、(本题共10分)
|
质量已知),其反应方程式为:3CuO+2NH3 = 3Cu+N2↑+3H2O,下图为该实验的装置图,其中量N2体积的装置E是由甲、乙两根玻璃管组成的,它们用橡皮管连通,并装入适量水,甲管有刻度,供量气用,乙管可上下移动,以调节液面高度。
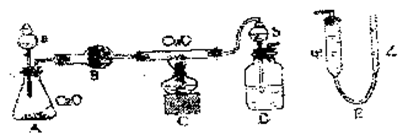 |
请回答以下问题:
(1)试剂a的名称为 ,锥形瓶内发生的化学反应方程式为 。
(2)装置D中b仪器的作用是 。
(3)实验开始时,在检验装置的气密性之后,必须首先 ,然后 ,再点燃C处酒精灯。
(4)反应前玻璃管和CuO总质量为m1g,反应结束后玻璃管和剩余固体质量为m2g,甲管量得气体体积为nL(标准状况),则氧的相对原子质量为 。
(5)为了较准确地测量N2体积,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意 (填字母)。
A、视线与凹液面最低处相平
B、等待片刻,待乙管中液面不再上升时,立刻读数
C、读数时应上下移动乙管,使甲、乙两管中液面相平
D、读数时要注意室内温度和气压
(6)下列操作可能造成测定结果偏高的是 (填字母)。
A、加热前未排尽系统内的空气 B、玻璃管内的CuO有剩余
C、将D处浓H2SO4换成水 D、读甲管终点视数时,俯视甲管内液面
五、本题包括两小题,共18分。
27、将铝件与另一种材料作电极,以某种溶液作电解液进行电解,通电后在铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝件表面形成一层较厚的氧化膜。某校研究性学习小组根据上述原理,以铝件和铁棒为电极,一定浓度的NaHCO3溶液为电解液进行实验。
(1)铝件表面形成氢氧化铝薄膜的电极反应式为:
(2)电解过程中,必须使电解液PH保持相对稳定(不能太大,也不能太小)的原因是
(3)使用NaHCO3溶液为电解液,会减缓阴极区溶液PH的增大,能说明这一原理的离子方程式为 。
28、A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A,A与D可形成气态化合物DA、DA2,A、B、D可组成离子晶体,该晶体的化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。已知X分子与B2A分子中的电子数相等,Y分子与最简式为BA的分子中的电子数相等。请回答:
(1)写出四种元素的符号:A ,B ,C ,D
(2)写出下列反应的化学方程式:
①C2+(BA)n →A2 ②C2+X →D2
现有C2与X的混合气体1mol,充分反应后,测知被还原的元素的质量比被氧化的元素的质量多18.5g,则原混合物中X与C2的物质的量之比为 。
(3)B4A3D2的化学式为 ,其水溶液显酸性的离子方程式为 。
 (4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为
。
(4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为
。
六、(本题共3小题,共25分)
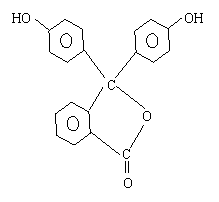
29、酚酞是常用的酸碱指示剂,其结构简式如图:
(1)酚酞的化学式为 。
(2)酚酞属于 、 类
衍生物。
(3)酚酞分别在1mol·L—1盐酸和1mol·L—1
NaOH溶液中溶解,在 中溶解度较大,原因
是 。
(4)烧碱溶液中加入几滴酚酞再加热可能的现象是 。
(5)在用标准盐酸滴定待测氢氧化钠的溶液中,若用酚酞作指示剂用量过多,对测定结果的影响是 。
30、(7分)有机物A和B无论以何种比例混合,其组成的混合物中所含原子的核外电子总数均不变。
(1)若A是分子中含8个氢原子的烃,B是分子中含3个碳原子的烃的含氧衍生物。写出两组符合上述要求的有机物的分子式。
①相对分子质量之差为2:A B
②相对分子质量相等:A B
(2)若A是分子中含有4个碳原子的烃,B是饱和链烃的一元含氮衍生物。则A分子式为 ,B的分子式为 ,符合B分子式的同分异构体有 种。
31、为扩大现有资源的使用效率,在一些油品中加入降凝剂J,以降低其凝固点,扩大燃料油品的使用范围。J是一种高分子聚合物,它的合成路线可以设计如下,其中A的氧化产物不发生银镜反应:
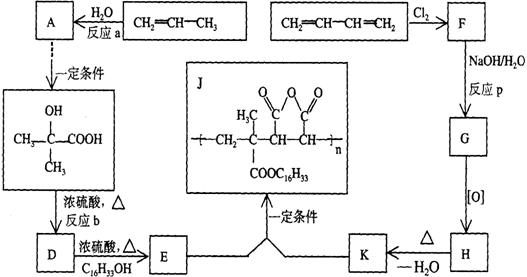
试写出:
(1)反应类型:a_________、b__ __p____ _;
(2)结构简式:F_________、H____________;
(3)化学方程式:D→E_________,E+K→J__________。
七、(本题包括2小题,共14分)
32、现有100mL,1mol/L的纯碱溶液和100mL 1.25mol/L的盐酸,
(1)若将上述纯碱溶液逐滴加入到盐酸溶液中,忽略CO2溶解的量,求收集到CO2的体积(标准状况);
(2)若将上述盐酸逐滴加入到纯碱溶液中,反应完全后,CO2在溶液中的浓度为0.04mol/L,假定溶液的体积不变,求收集到的CO2的体积和生成物NaCl的物质的量浓度。
33、在4000C,101.3k Pa时,3L某烃A在mL氧气中完全燃烧,燃烧后测得气体体积(m+6)L(气体体积均在同温同压下测定)试回答下列问题:
(1)通过计算说明,烃A的组成中应满足的条件。
(2)通过计算推断,当m=27时,烃A可能的分子式(只要求写出三种可能的分子式)。
三种可能的分子式是: , , 。
(3)通过计算确定,若烃A在常温常压下为气态物质时,m的取值范围。
7
高三化学参考答案
一、二、三选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| D | B | D | B | C | B | AC | AD | B | AD | D | C | BD |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | / |
| C | C | C | CD | B | A | B | B | A | B | B | B |
![]() 26、(1) 浓氨水 NH3·H2O NH3↑+H2O
26、(1) 浓氨水 NH3·H2O NH3↑+H2O
(2) 防止倒吸
(3)
装药品 打开分液漏斗活塞 (4)![]()
(5) ACD (6) D
27、(1) 阳极:Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑
(2) Al2O3+3Cl2均为两性化合物,PH太小或太大都会使薄膜溶解
(3) OH-+HCO3-=CO32-+H2O
28、(1)A O B H C Cl D N
(2)① H2O2+Cl2=O2+2HCl ② 2NH3+3Cl2=N2+6NH4Cl或8NH3+3Cl2=N2+6NH4Cl 1:4或7:3
![]()
![]() (3) NH4NO3 NH4++H2O NH3·H2O+H+
(3) NH4NO3 NH4++H2O NH3·H2O+H+
(4) 2NH3 NH4++NH2-
29、(1) C20H14O4
(2) 酚 醋
(3) 1mol·L-1NaOH 酚酞均易与碱反应
(4) 红色加热后褪色
(5) 偏低
30、(1)①A C4H8 B C3H6O
②A C7H8 B C3H8O3
(2)A C4H10 B C3H9N 4
31、(1)a 加成 b 消去 p 取代
![]() (2)F CH2—CH=CHCH2 H 7 HOOC—CH=CH—COOH
(2)F CH2—CH=CHCH2 H 7 HOOC—CH=CH—COOH
![]() (3)D→E C16H33OH+CH2=C—COOH CH2=C—COOC16H33+H2O
(3)D→E C16H33OH+CH2=C—COOH CH2=C—COOC16H33+H2O
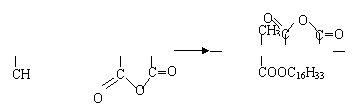
E+K → J nCH2=C—COOC16H33+nCH2=CH [CH2—C—CH—CH] n
32、(1)1.4L
(2)0.381L 0.625mol/L
33、(1)烃A的组成应满足条件是每个分子中含8个氢原子
(2)C3H8 C4H8 C5H8 C6H8 C7H8中任三种
(3)m≥18