高三年级第一学期化学第二次测评试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。考试时间120分钟,满分150分。
相对原子质量:H—1 C—12 O—16 S—32 Na—23 Cl—35.5 K—39 Cu—64
Zn—65
第Ⅰ卷(选择题 共71分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共27分)
1.厄尔尼诺现象产生的原因之一是大气中CO2的含量剧增,要想减缓这一现象的发生,最
理想的燃料是 ( )
A.天然气 B.氢气 C.液化石油气 D.酒精
2.下列物质均有杀菌消毒作用,其中杀菌能力强又不会影响水质的是 ( )
A.液氯 B.漂白粉 C.臭氧(O3) D.过氧化钠
3.我国科学工作者在世界上首次发现铂的一种新同位素![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.![]() 的相对原子量为202
的相对原子量为202
B.![]() 的原子质量为202
的原子质量为202
C.铂元素的质量数为202
D.![]() 的原子核内有124个中子
的原子核内有124个中子
4.下列物质的溶液,不易被氧化、不易分解且能存放在具有磨口玻璃塞的无色试剂瓶中的
是 ( )
A.烧碱 B.硝酸 C.醋酸 D.苯酚
5.下列事实与氢键有关的是 ( )
A.水加热到很高温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
6.实验室了为了简便制取干燥的氨气,下列方法中适合的是 ( )
A.加热氯化铵固体,产生的气体用碱石灰干燥
B.在N2和H2混合气中加入铁触媒并加热至500℃
C.在浓氨水中加入NaOH固体并加热,产生的气体固体NaOH干燥
D.加热NH4HCO3,生成的气体用P2O5干燥
7.以石墨作电极,电解CuSO4溶液,若阳极上析出氧气8g,则此时在阴极上析出铜的质量
是 ( )
A.8g B.16g C.32g D.64g
8.短周期元素X和Y,X元素位于Y的前一周期,其原子最外电子层只有一个电子,Y原
子的次外层电子数是最外层电子数的![]() ,则X和Y形成的化合物的化学式可表示为( )
,则X和Y形成的化合物的化学式可表示为( )
A.X2Y3 B.X3Y C.XY2 D.X2Y
9.锌—锰干电池在放电时的总反应方程式为 ( )
Zn+2MnO2+2NH4+ Zn2++Mn2O3+2NH3+H2O
则在电池放电时,碳棒正极上发生反应的物质是 ( )
A.MnO2和NH4+ B.Zn2+和NH3 C.Zn D.C
二、选择题(每小题只有一个选项符合题意,每小题4分,共44分)
10.将NO3—+Zn+OH—+H2O→NH3+Zn(OH)42—配平后,离子方程式中OH—的化学计量数是
( )
A.1 B.3 C.5 D.7
11.已知在酸性溶液中下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;Cr2O72—→2Cr3+;NO3—→NO;MnO4—→Mn2+。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是 ( )
A.Fe3+ B.Cr2O72— C.HNO3 D.MnO4—
12.将m1g锌加到m2g20%盐酸中,反应结束后共放出xLH2(标准状况),则被还原的HCl的物质的量一定是 ( )
A.(m1/65)mol B.(5m2/36.5)mol C.(m2/36.5)mol D.(x/11.2)mol
|
14.能正确表示下列化学反应的离子方程式是 ( )
A.用碳酸钠溶液吸收少量的二氧化硫:2CO32—+SO2+H2O 2HCO3—+SO32—
B.金属铝溶于盐酸中:Al+2H+ Al3++H2↑
![]() C.硫化钠溶于水中:S2—+2H2O H2S↑+2OH—
C.硫化钠溶于水中:S2—+2H2O H2S↑+2OH—
D.碳酸镁溶于硝酸中:CO32—+2H+ H2O+CO2↑
15.下列各组物质互到作用时,生成物不随反应条件或反应物的量变化而变化的是( )
A.Na和O2 B.NaOH和CO2
C.NaHCO3和NaOH D.Na2CO3和HCl
16.用惰性电极电解一定浓度的下列物质的水溶液,通电一段时间后,溶液的pH增大,向剩余电解液中加适量水,能使溶液与电解前相同的是 ( )
A.NaOH B.H2SO4 C.CuCl2 D.NaCl
17.将H2、O2、N2三种气体分别放入不同容器中,使它们的温度、密度相同,则其压强(p)大小的关系符合 ( )
A.P(H2)>P(O2)>P(N2) B.P(O2)>P(N2)>P(H2)
C.P(H2)>P(H2)>P(O2) D.P(N2)>P(O2)>P(H2)
18.常温下,在pH=9的氢氧化钠溶液和pH=9的醋酸钠溶液中,假设由水电离出的OH—的浓度分别为a mol/L和b mol/L,则a和b的关系是 ( )
A.a=1×10—4b B.b=1×10—4a C.a>b D.a=b
19.下列说法中,正确的是 ( )
A.周期表中的主族都有非金属元素
B.周期表中的主族都有金属元素
C.周期表中的非金属元素都位于短周期
D.周期表中的非金属元素都位于主族和0族
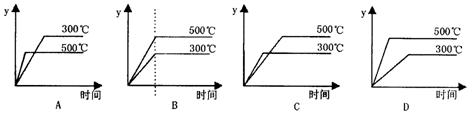
20.将等质量的两份锌粉a和b,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a的烧杯中再加入少量CuO粉末。下列各图表示氢气体积V(H2)与反应时间t的关系,其中正确的是 ( )
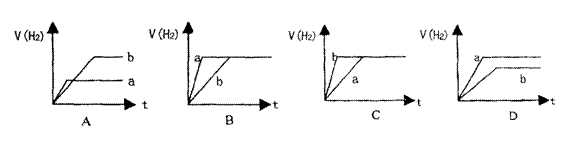 |
第Ⅱ卷(非选择题 共79分)
三、(本题包括2小题,共28分)
21.(8分)有两瓶失去标签的白色固体,一瓶是Na2SO4,一瓶是NH4Cl。请你设计四种实验方案加以鉴别,简要写出操作过程、实验现象和结论。
| 方案 | 操作过程(简要叙述) | 现象和结论 |
| (1) | ||
| (2) | ||
| (3) | ||
| (4) |
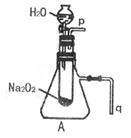
|
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二, 。Na2O2跟
水反应的化学方程式是 ,
其中还原剂是 ,氧化剂是 。
(2)某研究性学习小组拟用A图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是:
用以验证第二条结论的实验方法是:
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: 。
现象: 。
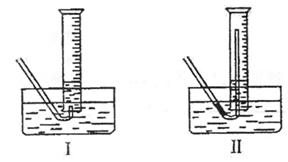
|
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的(忽略导管在量筒中所占的体积) (填序号),理由是
。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为 (选填“100mL”“200mL”“500mL”或“1000mL”)。
四、(本题包括2小题,共18分)
23.(8分)已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol.
(1)写出该反应配平的化学方程式:
(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为 。
(3)阿伏加德罗数常数为(用含a、b的代数式表示) 。
24.(10分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
![]() H2A
H2A H++HA— HA— H++A2—
回答下列问题:
(1)Na2A溶液显 (选填“酸性”“中性”或“碱性”),理由是(用离子方程式表示) 。
(2)若0.1mol·L—1NaHA溶液的pH=2,则0.1 mol·L—1H2A溶液中H+的物质的量浓度可能是 0.11mol·L—1(选填“<”“=”“>”)。理由是
。
(3)0.1mol·L—1 NaHA溶液中各种离子物质的量浓度由大到小的顺序是
。
五、(本题包括2小题,共17分)
![]() 25.(9分)已知硫化氢与甲烷一样可在空气中燃烧,当氧气足量时其燃烧产物之一为二氧化硫。下列转化关系中A是一种正盐,D的相对分子质量比C大16,E是酸。X无论是强酸(非氧化性酸)还是强碱时都有如下转化关系(其它产物及条件均已略去):
25.(9分)已知硫化氢与甲烷一样可在空气中燃烧,当氧气足量时其燃烧产物之一为二氧化硫。下列转化关系中A是一种正盐,D的相对分子质量比C大16,E是酸。X无论是强酸(非氧化性酸)还是强碱时都有如下转化关系(其它产物及条件均已略去):
A → B → C → D → E
当x是强酸(非氧化性酸)时,A、B、C、D、E均含有同一种元素;当x是强碱时,A、B、C、D、E均含有另一种元素。
回答下列问题:
(1)A是 ,Y是 ,Z是 (填化学名称)。
(2)当X是强酸时,B的摩尔质量为34g/mol,E是 (填化学式),C→D的化学方程式是 。
(3)当X是强碱时,E是 (填化学式),B→C的化学方程式是 。
|
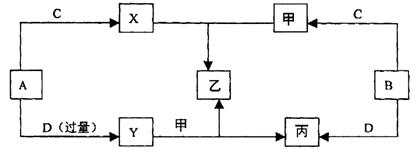
且知以上物质的所有组成元素均为短周期元素。根据以上事实,回答下列问题:
(1)化合物乙与氢氧化钠按物质的量之比1:3恰好完全反应,则乙的化学式是 。
(2)图中的化学反应共有 个化合反应, 个氧化还原反应。
(3)Y与甲反应生成乙和丙的化学方程式为: 。
六、计算题(本题包括2小题,共16分)
27.(10分)现在由等物质的量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。
(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的质量之比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 mol·L—1。
(3)如果盐酸过量,生成CO2的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道
。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是 。(不要求写计算过程)
28.(6分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:
![]() A(g)+2B(g) 3C(g)
A(g)+2B(g) 3C(g)
已知加入1molA和3molB且达到平衡后,生成了a mol C。
(1)达到平衡时,C在反应混合气中的体积分数是 (用含字线a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为 mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比 (选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C mol。(不要求写计算过程)
高三化学参考答案及评分标准
一、(每小题3分,共27分) 1.B 2.C 3.D 4.C 5.B 6.C 7.C 8.D 9.A
二、(每小题4分,共44分)
10.D 11.B 12.D 13.D 14.A 15.C 16.A 17.C 18.A 19.D 20.A
三、(共28分)
21.(8分)(1)用洁净的铂丝蘸取固体样品在火焰上灼烧;火焰呈黄色,原样品为Na2SO4
(2)分别取少量固体放入试管中加热;固体逐渐减少而消失的样品为NH4Cl
(3)分别取少量固体放入试管中加蒸馏水溶解,用pH试纸测试;溶液pH小于7的样品为NH4Cl
(4)分别取少量固体放入试管,加适量水溶解后,滴加BaCl2溶液;产生白色沉淀的样品为Na2SO4 (每空1分)(其他合理答案也给分)
22.(20分)(1)该反应是放热反应(1分);
2Na2O2+2H2O 4NaOH+O2↑(2分);Na2O2(1分);Na2O2(1分)
(2)将带火星的木条靠近导管口P处,木条复燃(3分);将导管q浸入水中,反应过程中导管口有气泡冒出(3分)
(3)MnO2(2分);气泡迅速产生,能使带火星的木条复燃(1分)(或Na2S溶液;溶液变浑浊。只要合理均可给分)
(4)①Ⅱ(1分) 防止气体冷却时发生倒吸现象(2分) ②500mL(3分)
四、(共18分)
23.(8分)(1)3NH3+3Cl2 6NH4Cl+N2(3分)
(2)3:2(2分) (3)![]() (3分)
(3分)
![]() 24.(10分)(1)碱性(1分);A2—+H2O HA—+OH—(2分)
24.(10分)(1)碱性(1分);A2—+H2O HA—+OH—(2分)
(2)<(2分);H2A第一步电离出的H+对HA—的电离起抑制作用(2分)
(3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)(3分)
五、(共17分)
 25.(9分)(1)硫化铵 氧气 水(每空1分)
25.(9分)(1)硫化铵 氧气 水(每空1分)
 (2)硫酸(1分) 2SO2+O2 2SO3(2分)
(2)硫酸(1分) 2SO2+O2 2SO3(2分)
(3)HNO3(1分) 4NH3+5O2 4NO+6H2O(2分)
26.(8分)
(1)H3PO4 (2)5;4 (3)PCl5+4H2O H3PO4+5HCl (每空2分)
六、(共16分)
27.(10分)(1)84:100(或21:25) (2)![]() (3)
(3)![]() (4)盐酸的物质的量浓度(其他合理答案也给分) 5)
(4)盐酸的物质的量浓度(其他合理答案也给分) 5)![]() (每空2分)
(每空2分)
28.(6分)(1)![]() ×100%(或25a%)(2分) (2)2a 不变(各1分) (3)6(2分)
×100%(或25a%)(2分) (2)2a 不变(各1分) (3)6(2分)