高三化学非金属单元测试
一、选择题:(每题只有一个正确答案)
1.目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉
及的是 ( )
A、二氧化硫 B、二氧化碳 C、二氧化氮 D、可吸入颗粒物
2.在医院中,为酸中毒病人输液不应采用 ( )
A、0.9%氯化钠溶液 B、0.9%氯化铵溶液
C、1.25%碳酸氢钠溶液 D、5%葡萄糖溶液
3.膦(PH3)又称为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之。它的分子是三角锥形。以下关于PH3的叙述正确的是 ( )
A、PH3是非极性分子 B、PH3分子中有未成键的电子对
C、PH3是一个强氧化剂 D、PH3分子中的P—H键是非极性键
4.第二次世界大战期间,某国有支侦查小分队到德国法西斯一座十分隐蔽且又戒备森严的军火厂。上级要求小分队在三天内必须炸毁它,结果他们用十多只涂有化学药剂的老鼠完成了任务。据你推测这种化学药剂是 ( )
A、TNT B、KMnO4和H2SO4 C、黑火药和甘油 D、白磷的CS2溶液
5.四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种流体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是 ( )
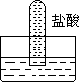
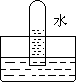

A B C D
6.酸雨是过度燃烧煤和石油,生成硫、氮的氧化物,溶于水生成硫酸和硝酸的缘故。某次雨水分析数据如下: c(SO42-)=2.6×10-5mol·L-1, c(Cl-)=8.0×10-6mol·L-1,c(NH4+)=3.0×10-6mol·L-1 ,c(Na+)=1.0×10-6mol·L-1,c(NO3-)=2.4×10-5mol·L-1。则此次酸雨的 PH 接近于 ( )
A、6.5 B、5 C、4 D、4.5
![]() 7.如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来
( )
7.如右图所示,两个连通容器用活塞分开,左右两室各充入一定量NO和O2,且恰好使两容器内气体密度相同,打开活塞,使NO与O2充分反应,最终容器内混合气体密度比原来
( )
A 、增大 B、 减小 C、 不变 D、 无法确定
8.ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为 ( )
A、1︰1 B、2︰1 C、1︰2 D、2︰3
二、选择题:(每题有一~两个正确答案)
9.NA为阿佛加德罗常数,下述正确的是 ( )
A 80g硝酸铵含有氮原子数为2NA
B 1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C 标准状况下,11.2L四氯化碳所含分子数为0.5 NA
D 在铁与硫的反应中,1mol铁失去的电子数为2 NA
10.某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 ( )
A.NH4+ B.Mg2+ C.Fe2+ D.Al3+
11.下列离子方程式中正确的是 ( )
A 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O
B NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-→NH3↑+H2O
C 苯酚钠溶液中通入少量CO2:![]() -O-+CO2+H2O→
-O-+CO2+H2O→![]() -OH+HCO3-
-OH+HCO3-
D FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl-
12.下面是实验室制取氨气的装置和选用的试剂,其中错误的是 ( )
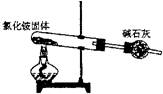
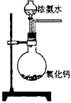


A B C D
13.向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 ( )
A NaCl Na2SO4 B NaCl NaBr Na2SO4
C NaCl Na2SO4 I2 D NaCl NaI Na2SO4
14.下列实验过程中产生的现象与对应的图形相符合的是 ( )
A NaHSO3粉末加入HNO3溶液中 B H2S气体通入氯水中
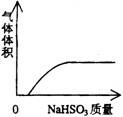
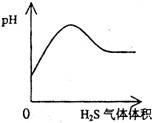
C NaOH溶液滴入Ba(HCO3)2溶液中 D CO2气体通入澄清石灰水中
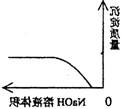
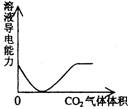
15.往100mL3mol/L的稀硝酸中加入一定量的铁铜混合粉末,充分反应后过滤,再往滤渣中滴入稀盐酸,发现有氢气产生,则滤液中 ( )
A 、一定含Fe2+、不含Fe3+和Cu2+
B、含Fe2+、不含Cu2+、可能含Fe3+
C、可能含Fe2+、Fe3+和Cu2+
D、可能含Fe3+和Cu2+、不含Fe2+
16.氢化铵(NH4H)与氯化铵结构相似,又已知NH4H与水反应有氢气产生,下列叙述不正确的是 ( )
A NH4H的电子式是: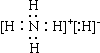
B NH4H固体投入少量水中,有两种气体产生
C NH4H中的H-离子半径比锂离子半径大
D NH4H溶于水后,形成的溶液呈酸性
17.下列操作中固体可完全溶解的是 ( )
A. 1mol Al与含1mol H2SO4的稀H2SO4溶液共热
B. 1mol Cu与含2mol H2SO4的浓H2SO4溶液共热
C. 1mol Cu与含4mol HNO3的浓HNO3溶液共热
D.1mol MnO2与含4mol HCl的浓HCl溶液共热
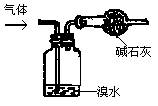 18.下列四种气体(括号内是混有的少量杂质),其中可用右图所示仪器装置进行净化和干燥的气体是
( )
18.下列四种气体(括号内是混有的少量杂质),其中可用右图所示仪器装置进行净化和干燥的气体是
( )
A. CO2( HCl) B.C2H6(C2H4)
C.CO2(SO2) D.NH3(N2)
三、填空题:
19.有一瓶澄清的溶液,其中可能含NH4+、K+、Na +、Mg2+、Ba2+、 Al3+、 Fe3+、SO42-、CO32-、NO3- 、Cl-、I-,取该溶液进行如下实验:
⑴用pH试纸检验,表明溶液呈强酸性;
⑵取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
⑶取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
⑷取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的上述离子有 ,肯定不存在的上述离子有 ,还不能确定是否存在的上述离子有 。
![]() 20.某学生拟利用下列两个在室温下能顺利进行的反应,在实验室制取少量纯净的氮气。
20.某学生拟利用下列两个在室温下能顺利进行的反应,在实验室制取少量纯净的氮气。
3Cl2+2NH3=N2+6HCl NH3·H2O(浓) NH3↑+H2O
实验时,可供选择的仪器装置如下图所示。

实验时可供选择的试剂有:①饱和食盐水,②浓硫酸,③浓硝酸,④浓盐酸,⑤稀烧碱溶液,⑥碱石灰,⑦二氧化锰粉末,⑧浓氨水。
该生设计的实验流程是:
 |
回答下列问题:
⑴在所给出的仪器装置中,要组装成制得纯净的氨的装置,按实验时装置合理连接的先后顺序应依次选取_______(填图中仪器装置的代号);制得纯净的氯气选用的试剂是_________(填试剂的编号)。
⑵利用浓氨水和氢氧化钠固体制氨时,氢氧化钠固体的作用是__________;此时若用碱石灰代替氢氧化钠,能否达到目的?_____。
⑶氯气跟氨的反应应在装置__________(填装置代号)中进行,生成的氮气中可能会混有的杂质气体有______________________;若生成的氮气中混有氯气或氯化氢气体,则净化时先后依次通过的试剂是__________(填试剂的编号)。
21.由于用氯气对饮用水消毒,会使水中的有机物发生氯代,生成有机含氯化合物,与人体有害,世界环保联盟将全面禁止这种消毒方法,建议采用广谱性具有强氧化性的高效消毒剂ClO2。ClO2极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
(1)在ClO2分子中,所有原子是否都满足最外层8电子结构? (填“是”或“否”) ,其中氯的化合价是 。
(2)欧洲一些国家用NaClO3氧化浓HCl制ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,表示这一反应的化学方程式为 。
(3)我国广泛采用将经干燥空气中稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,表示这一反应的化学方程式是 。
我国这一方法较欧洲方法的主要优点是 。
(4)在酸性溶液中,用草酸钠(Na2C2O4)还原NaClO3也可得ClO2,这一反应的离子方程式是 ,此法的优点是 。
22.A、B两种盐均为无色晶体,其中A的焰色反应呈紫色(透过蓝色钴玻璃),A的水溶液pH大于7。下面是对A、B两种盐所进行的实验记录(见下图),其中H、G均为不溶于酸的白色沉淀。
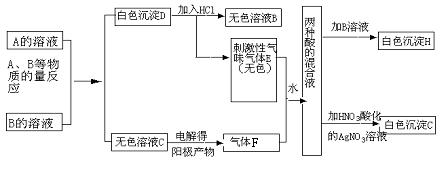
(1)写出A、B两种盐的化学式A ;B 。
(2)写出A、B反应的离子方程式: 。
(3)写出F+E+H2O反应的化学方程式: 。
(4)电解C的无色溶液,阴、阳两极所得气体的体积比理论值为1:1,而实际收集到的气体的体积比却大于1:1,简单解释原因:
23.近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2的水蒸汽副产品,试写出上述两步反应的化学方程式
24.从某些方面看,氨和水相当,NH4+和H3O+(常简写为H+)相当,NH2-和OH-相当,NH2-(有时还包括N3-)和O2-相当。
(1)已知在液氨中能发生下列二个反应
NH4Cl+KNH2=KCl+2NH3 2NH4I+PbNH=PhI2+3NH3
请写出能在水溶液中发生的与上二反应相当的反应方程式。
(2)完成并配平下列反应方程式(M为金属):
M+NH3→
MO+NH4Cl→
M(NH2)2→
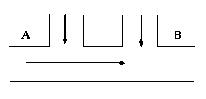 25.某工厂排出的废水中含氯气,为了除去废水中游离态氯,而且使废水变为中性,有人提出如图所示方案。在废水排出管的A、B处分别注入一定流量的废烧碱溶液和亚硫酸钠溶液。l
25.某工厂排出的废水中含氯气,为了除去废水中游离态氯,而且使废水变为中性,有人提出如图所示方案。在废水排出管的A、B处分别注入一定流量的废烧碱溶液和亚硫酸钠溶液。l
试写出:(1)A、B处应加入的物质的化学式为______________,_______________。
(2)A、B处反应离子方程式:
A:________________________________________。
B:___________________ _______。
26.现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为amol,Cu的物质的量分数为x;研成粉末后,全部投入含bmol HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:(已知:Cu+2Fe3+=2Fe2++Cu2+)
(1)随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有六种情况,请用粒子符号填写下列空白:
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 溶液中的金属离子 | Fe2+ | Fe2+、Cu2+ | Cu2+、Fe3+ | |||
| 残留固体成分 | Fe、Cu | Cu | — | — | — |
(2)当溶液中金属离子只有Fe2+、Cu2+时,求b的取值范围 。
四、计算题:
27.FeS能跟盐酸反应生成H2S气体和FeCl2。把8.8FeS放入200mL2.0mol/L的盐酸中,以制备H2S。反应完全后,若溶液中H2S的浓度为0. 1mol/L,假定溶液的体积不变,试计算
(1)收集到的H2S的体积;
(2)溶液中Fe2+、H+的浓度。
28.硫铁矿高温下空气氧化产生二氧化硫。设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00mol FeS2完全氧化,需要空气的体积(标准状况)为 L
(2)55L空气和足量FeS2完全反应后,气体体积(同温同压)变为 L
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
参考答案
1、B 2、B 3、B 4、D 5、C 6、B 7、C 8、B
9、AD 10、AC 11、AC 12、AC 13、AB 14、D 15、A 16、D 17、C 18、B
19.I-、NH4 +、Ba2+ SO42-、CO32-、NO3- 、Mg2+、Al3+、Fe3+
K+、Na +、Cl-
20.⑴AG (颠倒顺序不给分)(2¹) ④⑦①②(少一个不给分)(2¹)
⑵抑制NH3·H2O的电离和氨的溶解,使氨从溶液中逸出。(2¹)能 (1¹)
⑶F(1¹) NH3、Cl2、HCl中的一种或Cl2和HCl(2¹)⑤②(或⑥)(2¹)
21.(1)(2分)否 +4
(2)(2分)2NaClO3+4HCl Cl2↑+2NaCl+2H2O↑
(3)(4分)2NaClO2+Cl2 2ClO2+2NaCl 生成的ClO2中不含Cl2
(4)(4)2ClO3-+C2O42-+4H+
2ClO2↑+2CO2↑+2H2O析出的ClO2可被CO2稀释
22.(1)K2SO3
BaCl2
(2)SO32-+Ba2+
BaSO3↓
(3)SO2+Cl2+H2O=SO42-+2Cl-+4H+ (4)阴极产生Cl2溶解与碱性溶液中。
24.(1)H3OCl+KOH=KCl+2H2O或HCl+KOH=KCl+H2O 2H3OI+PbO=PbI2+3H2O或2HI+PbO=PbI2+H2O (2)M+2NH3=M(NH2)2+H2或M+NH3=MNH2+1/2H2 MO+2NH4Cl=MCl2+2NH3+H2O M(NH2)2→MNH+NH3或3M(NH2)2→M3N2+4NH3
27.根据方程式FeS+2H+====Fe2++H2S↑可判断盐酸过量,计算应以FeS的物质的量为基准.
(1)共生成H2S 0.10mol.在溶液中溶解的物质的量为:
0.10 mol·L-1×0.20 L=0.020 mol
所以收集到H2S气体的物质的量为:0.10 mol-0.020 mol=0.08 mol
收集到H2S气体的体积(标准状况)为:
22.4 L·mol-1×0.08 mol=1.8 L (2分)
![]()
![]()
28.(1)308 (2)52
(3)设SO2为X(体积分数),则有
4×(11×X/8+0.0800)=1-0.0800-X
X=0.0923