![]()
|
|
学科:化学 |
| 教学内容:高三化学复习:铁 |
一、考纲要求
1.掌握铁和铁的一些重要化合物的性质。
2.学会检验Fe3+的方法。
3.了解铁的合金(生铁、钢)的种类、成分、性能。
4.从原理、设备、生产过程、原料及氧化——还原反应的角度比较并掌握工业炼铁和炼钢。
三、知识结构
1.铁的重要氧化物的比较
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 色态 | 黑色粉末 | 红棕色粉末 | 铁黑色晶体 |
| 铁的价态 | +2 | +3 | +2,+3 |
| 水溶性 | 不溶 | 不溶 | 不溶 |
| 铁的氧化物与盐酸反应 | FeO+2HCl=FeCl2+H2O | Fe2O3+6HCl=2FeCl3+3H2O | Fe3O4+8HCl=FeCl2+2FeCl3+4H2O |
| 铁的氧化物与CO反应 | FexOy+yCO | ||
2.生铁与钢的比较
| 铁的合金 | 生铁 | 钢 |
| 含碳量 | 2%~4.3% | 0.0390~2% |
| 其它杂质 | 含硅、锰、硫、磷较多 | 含硅、锰少量,硫和磷几乎没有 |
| 机械性能 | 硬而脆、无韧性 | 硬而韧、有弹性 |
| 机械加工 | 可铸不可锻 | 可铸、可锻、可压延 |
3.炼铁和炼钢的比较
| 炼铁 | 炼钢 | |
| 原料 | 铁矿石、焦炭、石灰石、空气 | 生铁、空气(或纯氧、氧化铁)、生石灰、脱氧剂 |
| 化学原理 | 在高温下用还原剂从铁矿石里还原出来 | 在高温下用氧化剂把生铁里过多的碳和其它氧化为气体或炉清除去 |
| 主 要 反 应 | ①还原剂的生成 C+O2 CO2+C ②铁的还原 Fe2O3+3CO ③炉渣的生成 CaCO3 CaO+SiO2 | ①氧化:2Fe+O2 FeO氧化铁水里的Si、Mn、C等。如C+FeO
②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。 ③脱氧,并调整Mn、Si含量 2FeO+Si |
| 主要设备 | 高炉 | 转炉 |
三、能力点、知识点提示
1.铁在周期表中的位置及结构
铁位于第四周期第![]() 族,原子结构示意图为
族,原子结构示意图为![]()
2.铁的性质
(1)物理性质
银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
(2)化学性质
铁是较活泼的金属,常显+2、+3价,且Fe3+比Fe2+稳定。
①铁三角
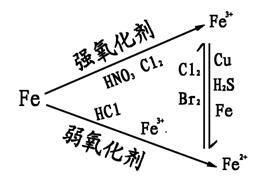
②铁及其重要化合物的转化关系
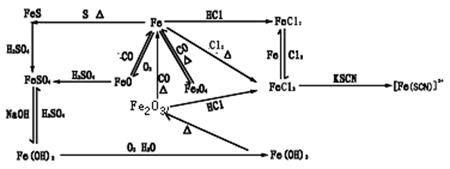
③Fe2+与Fe3+离子的检验;

3.铁的合金
一般地说,含碳量在2%~4.3%的铁的合金叫做生铁。生铁里除含碳外,还含有硅、锰以及少量的硫、磷等,它可铸不可煅。根据碳的存在形式可分为炼钢生铁、铸造生铁和球墨铸铁等几种。
一般地说,含碳量在0.03%~2%的铁的合金叫做钢。钢坚硬有韧性、弹性,可以锻打、
压延,也可以铸造。
钢的分类方法很多,如果按化学成分分类,钢可以分为碳素钢和合金钢两大类。碳素钢就是普通的钢。合金钢也叫特种钢,是在碳素钢是适当地加入一种或几种,如锰、铬、镍、钨、铜等合金元素而制成的。合金元素使合金钢具有各种不同的特殊性能。
4.炼铁
(1)反应原理:利用氧化——还原反应,在高温下,用还原剂(主要是CO)把铁从铁矿石里还原出来。
(2)原料:铁矿石、焦炭、石灰石和空气
(3)设备:高炉
(4)生产过程
①还原剂的生成
C+O2![]() CO2+热 CO2+C
CO2+热 CO2+C
![]() 2CO
2CO
②铁矿石还原成铁
Fe2O3+3CO
![]() 2Fe+3CO2↑
2Fe+3CO2↑
③除脉石、炉渣的形成
CaCO3![]() CaO+CO2↑
CaO+CO2↑
SiO2+CaO![]() CaSiO3
CaSiO3
5.炼钢
(1)设备:氧气顶吹转炉
(2)主要原料:炼钢生铁、生石灰、氧气。
(3)反应原理:利用氧化还原反应,在高温下,用氧化剂把生铁中过多的碳和其它杂质氧化为气体或炉渣除去。
(4)炼钢时的主要反应:
①氧化剂的生成,热能的来源 2Fe+O2![]() 2FeO+Q
2FeO+Q
②降低碳的含量 C+FeO![]() CO+Fe-Q
CO+Fe-Q
③除去S、P等杂质
④加硅铁、锰铁、铝除剩余FeO——脱氧
2FeO+Si![]() 2Fe+SiO2
2Fe+SiO2

【同步达纲练习】
(一)选择题:
1.下列物质发生反应时其离子方程式正确的是( )
A.铁与三氯化铁溶液反应
Fe+2Fe3+![]() 3Fe2+
3Fe2+
B.足量的氯气通入溴化亚铁溶液中
2Fe2++4Br-+3Cl2 ![]() 2Fe3++2Br2+6Cl-
2Fe3++2Br2+6Cl-
C.Fe(OH)3跟盐酸反应
Fe(OH)3+3H+ ![]() Fe3++3H2O
Fe3++3H2O
D.FeS跟稀硝酸反应
FeS+2H+=Fe2++H2S↑
知识点:离子方程式的书写规则及Fe的一些重要反应
能力点:再现能力、推理能力
2.测知由Fe2(SO4)3和FeSO4组成的混合物中含硫a%,则其含铁量应为( )
A.(100-4a)% B.(100-2a)%
C.(100-a)% D.(100-3a)%
知识点:考查化合物中各元素的质量百分比
能力点:推理计算能力
3.下列试剂能用来分离Fe3+与Al3+的是( )
A.NH3·H2O B.NaOH
C.(NH4)2CO3 D.HCl
知识点:Fe3+与OH-反应与Al3+不同。
能力点:再现能力、推理能力。
4.往100mL FeBr2溶液中缓慢通入2.24L(标况)氯气,结果溶液中有1/3溴离子被氧化成溴单质,原FeBr2溶液的物质的量浓度为( )
A.1.4mol/L B.2.8 mol/L
C.1.2 mol/L D.无法计算
知识点:当Fe2+、Br-遇到强氧化剂Cl2时均表现为还原性。
能力点:计算推断能力,再现能力。
5.下列各组离子在溶液中能大量共存的是( )
A.Fe3+、S2-、HCO-3、K+
B.Fe2+、H+、NO-3、SO2-4
C.Fe3+、Mg2+、NO-3、Cl-
D.Fe2+、Cu2+、Cl-、NO-3
知识点:离子共存的条件
能力点:再现能力、发散思维能力
6.有100毫升0.1 mol/L 的FeCl3溶液与50mol 0.1mol/L的AgNO3溶液混合后,混合液各离子浓度由大到小的顺序是( )
A.[Cl-]>[Fe3+]>[Ag+]>[NO-3]
B.[Cl-]>[Fe3+]>[NO-3]>[Ag+]
C.[Fe3+]>[NO-3]>[Cl-]>[Ag+]
D.[NO-3]>[Fe3+]>[Cl-]>[Ag+]
知识点:离子浓度的计算
能力点:推理能力、发散思维能力
7.下列关于电解法精炼粗铜的叙述中不正确的是( )
A.粗铜作阳极
B.电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e=Cu
C.粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形成沉积槽底,形成阳极泥
D.电解铜的纯度可达99.95%~99.98%
知识点:电解法炼粗铜的原理。
能力点:分析综合能力。
8.在炼钢结束时,常在钢水中加一些硅铁、锰铁,其目的是( )
A.除氧化 B.还原氧化铁
C.除硫磷 D.除去过量的氧化亚铁
知识点:炼钢过程中加入一些原料的作用
能力点:再现能力、辨认能力
9.下列生产工业①制生石灰 ②制水泥 ③制普通玻璃 ④炼铁 ⑤炼钢 ⑥制漂白粉 ⑦ 硬水软化,其生产原料中直接使用石灰石的是( )
A.只有①③⑦ B.只有②④⑤
C.只有①④⑥ D.只有①②③④
知识点:一些工业生产中的原料及用途
能力点:再现能力、推断能力
10.下列有关炼铁和炼钢的说法中,错误的是( )
A.炼铁是铁矿石被还原的过程
B.炼钢是生铁被氧化的过程
C.炼铁高炉中加入石灰石的目的是除去脉石
D.炼钢转炉中加入的生石灰是造渣剂.
知识点:炼钢和炼铁的原理和目的
能力点:再现能力、推断能力
11.将10g铁碳合金放入氧气中高温灼烧,反应后的气体通入过量石灰水中得沉淀1.4g。此铁碳合金是( )
A.生铁 B.高碳钢 C.中碳钢 D.低碳钢
知识点:合金钢的定义及含碳范围
能力点:计算能力,辨析能力
12.一定量的Fe和Fe2O3组成的混合物,投入到250 mL 2mol/L的HNO3溶液中,反应完成后,生成1.12 L NO(标况);再向溶液中加入1 mol/L的NaOH溶液,要使溶液中的铁元素完全沉淀下来,所加入的NaOH溶液体积最少要( )
A.450 mL B.500 mL
C.400 mL D.无法确定
知识点:铁及铁的氧化物与酸、碱反应的一些性质。
能力点:综合计算能力。
(二)非选择题
13.将10.416g纯铁丝溶于过量盐酸,在加热下用5.050g KNO3去氧化溶液中的Fe2+ ,待反应完全后,剩余的Fe2+还需要24 mL 0.3 mol/L的KMnO4溶液才能完全氧化, 其反应方程式为:KMnO4+5FeCl2+8HCl=KCl+MnCl2+5FeCl3+4H2O,试通过计算确定KNO3的还原产物,并写出KNO3与FeCl2反应的化学方程式。
知识点:Fe2+的还原性
能力点:发散思维能力
14.混有铝的铁屑与盐酸反应,离子方程式为 ;加入适量的氢氧化钠溶液,反应的离子方程式为 、 ;再加入过量的NaOH溶液,反应的离子方程式为 ;生成的沉淀在空气中放置,发生反应的方程式为 。
知识点:Fe3+与碱的反应,Al3+与碱的反应。
能力点:归纳能力、再现能力
15.关于高炉炼铁,回答:
(1)冶铁的原料有 .
(2)焦炭的作用有二:a是 ,化学方程式为 ;b是 ,化学方程式为 .
(3)铁矿石的作用是 ,化学方程式(以赤铁矿为例)为 .
(4)生石灰的作用是 ,化学方程式为 、 .
知识点:炼铁的过程
能力点:再现能力
16.关于氧气顶吹转炉炼钢,回答:
(1)原料是 ;
(2)生石灰的作用是 ,吹炼完毕时,加入硅铁 、锰铁或金属铝的目的是 .
知识点:炼钢的原料及作用
能力点:再现能力
17.如下图所示,A为两种元素组成的化合物,B为能使品红溶液褪色的气体,G为红褐色沉淀 ,试写出A、B、C、D、E、F、G各物质的分子式
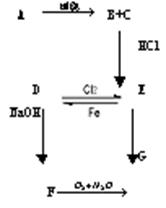
知识点:Fe的化合物
知识点:Fe的化合物之间的变化关系
能力点:再现能力、归纳能力
18.在铁和氧化铁的混合物15g中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并 使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH,溶液200mL。求:
①混合物中铁和氧化铁各多少克?
②稀H2SO4的物质的量浓度为多少?
知识点:Fe与Fe3+的反应,以及Fe2+与碱的反应
能力点:计算能力、发散思维能力
19.某铁碳合金中已有部分铁被氧化生锈(假设铁锈成分为Fe2O3)取样品19.4g,加足量的稀盐酸使它溶解,放出氢气3.36L(标况),所得溶液中滴入硫氰化钾溶液不变色。若将溶液中的金属离子全部氧化成高价离子,需通入标况下氯气3.36L(不考虑氯气与水的反应)。 求该合金未被氧化时铁的质量分数。
知识点:Fe与HCl的反应,Fe2+的反应特点。
能力点:发散思维能力、计算能力。

参考答案
【同步达纲练习】
(一)选择题
1.B、C 2.D 3.B 4.C 5.C、D 6.B 7.C 8.D 9.D 10.B 11.B 12.A
(二)非选择题
13.题意要求写出KNO3在酸性条件下将FeCl2氧化的化学方程式,这实上是转化为Fe2+和HNO3之间的氧化还原反应,其中氧化产物为Fe3+,关键是KNO3被还原产物如 何确定,这是此题的突破口。HNO3作为强氧化剂,其还原产物较复杂,浓HNO3一般被还原为NO2,稀HNO3一般被还原为NO,也有可能被还原成N2O、N2,甚至是NH4+等不同价态,所以完成此题需根据氧化还原反应中得失电子总数相等的原则来确定反应后氮元素的价态。依题Fe2+变为Fe3+失去电子总数应等于NO3-和MnO4-得电子总数之和。设x为KNO3的还原产物中氮元素的价态,则有:
![]() ×(3-2)=0.3×24×10-3×(7-2)+
×(3-2)=0.3×24×10-3×(7-2)+![]() (5-x)
(5-x)
解之:x=2,故KNO3的还原产物为NO。所以KNO3与FeCl2反应的化学方程式为:
KNO3+3FeCl2+4HCl=KCl+3FeCl3+2H2O+NO↑
14.2Al+6H+=2Al3++3H2↑,Fe+2H+=Fe2++H2↑
Al3++3OH-=Al(OH)3↓,Fe2++2OH-=Fe(OH)2↓
Al(OH)3+OH-=AlO-2+2H2O
4Fe(OH)2+O2+2H2O=4Fe(OH)3
15.①铁矿石、焦炭、石灰石、空气
②燃烧提供大量的热:C+O2
![]() CO2+Q产生炼铁的还原剂CO,CO2+C
CO2+Q产生炼铁的还原剂CO,CO2+C![]() 2CO
2CO
③提供铁元素:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
④作熔剂除掉SiO2:CaCO3![]() CaO+CO2
CaO+CO2
CaO+SiO2![]() CaSiO3
CaSiO3
16.①炼钢生铁、氧气、生石灰
②造渣;使钢水脱氧即除去FeO.
17. A.FeS或FeS2 B.SO2 C.Fe2O3
D.FeCl2 E.FeCl3 F.Fe(OH)2
G.Fe(OH)3
18.解:设铁和氧化铁的物质的量分别为x和y,则
x×56g/mol+y×160 g/mol=15g……………①
由得失电子守恒得,x×2=y×1+1.68L/22.4L/mol×2……………②
解得:x=0.25mol, y=0.05mol.即m(Fe)=0.25mol×56g/mol=7g, m(Fe2O3)=0.05mo l×160g/mol=8g
(2)在铁和氧化铁的混合物中加入稀H2SO4反应停止后,溶液中的溶质主要是H2SO4 和FeSO4。
由电荷守恒知:硫酸中的硫酸根离子最后完全和钠离子结合在一起。
n(H2SO4)=1/2×3 mol/L×0.2L=0.3mol
c(H2SO4)=0.3 mol/0.15L=2 mol/L
19. 解:设铁合金被氧化后含Fe x mol,Fe2O3 y mol.
且其中H2:![]() =0.15(mol)
=0.15(mol)
根据得失电子守恒有 x![]() 2=2y
2=2y![]() 1+0.15
1+0.15![]() 2 ①
2 ①
又∵Fe2+![]() Fe3+时据得失电子守恒有
Fe3+时据得失电子守恒有
x+2y=0.15×2 ②
通过①②计算方知x=0.20 y=0.05
则计算得Fe和Fe2O3的质量和为
56×0.20+160×0.05=19.2(g)
∴19.4-19.2=0.2(g)为合金中杂质的质量.
则未氧化前Fe的质量为(0.05×2+0.20) ×56=16.8(g)
∴Fe的质量分数为![]() ×100%=98.8%.
×100%=98.8%.
