高三化学基础知识检测(一)
化 学
本试卷分第Ⅰ卷(客观题)和第Ⅱ卷(主观题)两部分,共150分。考试时间为120分钟。
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 S 32 K 39
第Ⅰ卷(共73分)
一、选择题(本题包括11小题,每小题3分,共33分。每小题只有一个选项符合题意。)
1.某气体在近地面空气中浓度稍大时是一种污染物,而在高空对人类有保护作用,该气体是 ( )
A.NO B.![]() C.CO D.氯氟烃
C.CO D.氯氟烃
2.据最新报道,放射性核素钬![]() 可有效地治疗肝癌,该核素原子核内的中子数与核外电子数之差是 ( )
可有效地治疗肝癌,该核素原子核内的中子数与核外电子数之差是 ( )
A.32 B.67 C.99 D.166
3.成功合成纳米氮化镓是我国科学家近年来取得的一项重大科技成果。已知镓是第ⅢA族元素,则氮化镓的化学式可能是 ( )
A.![]() B.
B.![]() C.GaN D.
C.GaN D.![]()
4.下列保存有关物质的方法,错误的是 ( )
A.氨水放在橡皮袋中
B.烧碱溶液放在带橡胶塞的玻璃瓶中
C.浓硝酸放在带橡胶塞的棕色玻璃瓶中
D.少量白磷放在水中
5.下列所述实验操作中,正确的是 ( )
A.用润湿的pH试纸测试醋酸溶液的pH
B.用稀盐酸清洗做过焰色反应实验的铂丝
C.做完银镜反应实验后,用浓氨水洗涤试管上的附着物
D.皮肤上沾有苯酚,应马上用氢氧化钠溶液冲洗
6.下列各组物质发生状态变化时,所克服的微粒间的相互作用,属于同种类型的是 ( )
A.钠和硫的熔化 B.食盐和石蜡的熔化
C.碘和干冰的升华 D.二氧化硅和氧化钠的熔化
7.已知lmol白磷转化为红磷时放出18.39kJ的热量。在下列两个反应中:
4P(白、s)+5![]() (g)
(g)![]() 2
2![]() (s);△H=-akJ/mol(a>0)
(s);△H=-akJ/mol(a>0)
4P(红、s)+5![]() (g)
(g)![]() 2
2![]() (s);△H=-bkJ/mol(b>0)
(s);△H=-bkJ/mol(b>0)
a和b的关系为 ( )
A.a<b B.a=b C.a>b D.无法确定
8.某元素的原子最外层有2个电子,该元素是 ( )
A.金属元素 B.ⅡA族元素
C.稀有气体元素 D.无法确定
9.0.1mol某单质与1.6g硫在一定条件下恰好完全反应,该单质可能是( )
A.![]() B.Na C.
B.Na C.![]() D.Mg
D.Mg
10.下列反应中,调节反应物用量或浓度不会改变反应产物的是 ( )
A.二氧化硫通入烧碱溶液 B.甲烷在氧气中燃烧
C.铁在硫蒸气中燃烧 D.硫酸中加入锌粉
11.室温下,等体积0.5mol/L的下列物质的水溶液中,所含阳离子数目由多到少的顺序是 ( )
①KCl ②![]() ③HF ④
③HF ④![]()
A.④>①=②>③ B.④>①>②>③
C.①>④>③>② D.④>②>①>③
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个选项符合题意。)
12.若![]() 表示阿伏加德罗常数的数值,下列说法错误的是 ( )
表示阿伏加德罗常数的数值,下列说法错误的是 ( )
A.1mol ![]() 所含质子数为10
所含质子数为10![]()
B.0.5mol Al与足量的氢氧化钠溶液反应转移的电子数为1.5![]()
C.在标准状况下,0.5![]() 个氯气分子所占的体积约是11.2L
个氯气分子所占的体积约是11.2L
D.不在标准状况下,22.4L![]() 含有的分子数一定不是
含有的分子数一定不是![]()
13.在某温度下,NaOH的溶解度为20g,该温度下将80gNaOH放入220g水中,充分搅拌后,测得溶液的密度为1.2g/![]() ,则溶液中溶质的物质的量浓度为( )
,则溶液中溶质的物质的量浓度为( )
A.0.02mol/L B.2.0mol/L C.5.0mol/L D.7.5mol/L
14.下列事实不能用勒夏特列原理解释的是 ( )
A.加入催化剂能加快![]() 转化为
转化为![]() 的速率
的速率
B.配制![]() 溶液时,向溶液中加入少量盐酸
溶液时,向溶液中加入少量盐酸
C.往醋酸溶液中加碱溶液,有利于![]() 的增多
的增多
D.水中加入酸可以抑制水的电离
15.航天技术上使用一种氢氧燃料电池,它具有高能轻便、不污染环境等优点,该电池总反应方程式为:2![]() +
+![]() =2
=2![]() ,该电池的正极反应可表示为( )
,该电池的正极反应可表示为( )
A.![]() +4
+4![]()
![]() 2
2![]() ↑
B.
↑
B.![]() +
+![]() +4
+4![]()
![]() 4
4![]()
C.4![]() -4
-4![]()
![]()
![]() ↑+2
↑+2![]() D.
D.![]() -4
-4![]()
![]() 4
4![]()
16.臭氧可使湿润的淀粉碘化钾试纸变蓝,化学方程式为:
2KI+![]() +
+![]()
![]() 2KOH+
2KOH+![]() +
+![]()
下列叙述正确的是 ( )
A.![]() 在反应中被氧化成
在反应中被氧化成![]()
B.该反应的还原产物是![]()
C.1mol![]() 在反应中得到2mol
在反应中得到2mol ![]()
D.反应中氧化产物与还原产物物质的量之比为1∶2
17.物质的量浓度均为0.01mol/L的HA和BOH溶液,pH分别为3和12,将两溶液等体积混合后,所得溶液的pH ( )
A.≥7 B.一定>7 C.≤7 D.可能=7
18.将氨水逐滴加入到稀盐酸中,使溶液为中性,则此时 ( )
A.c(![]() )=c(
)=c(![]() )
)
B.c(![]() )>c(
)>c(![]() )
)
C.c(![]() )<c(
)<c(![]() )
)
D.c(![]() )与c(
)与c(![]() )之间关系不确定
)之间关系不确定
19.有n mol金刚石中,含C—C非极性键数是 ( )
A.2n×6.02×![]() B.n×6.02×
B.n×6.02×![]()
C.4n×6.02×![]() D.8n×6.02×
D.8n×6.02×![]()
20.在一容积不变的密闭容器中充入2 mol A和1 mol B发生反应:2A(g)+B(g)![]() xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后C的体积分数仍为W%,则x值为 ( )
xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后C的体积分数仍为W%,则x值为 ( )
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
21.某![]() 样品中含有
样品中含有![]() 、
、![]() 和
和![]() 三种杂质中的一种或两种,现将13.8g样品中加入足量水,样品全部溶解,再加入过量的
三种杂质中的一种或两种,现将13.8g样品中加入足量水,样品全部溶解,再加入过量的![]() 溶液,得到9g沉淀。对样品所含杂质的正确判断是 ( )
溶液,得到9g沉淀。对样品所含杂质的正确判断是 ( )
A.肯定没有![]()
B.肯定有![]() ,可能还有
,可能还有![]()
C.肯定没有![]() ,可能有
,可能有![]()
D.肯定没有![]() 和
和![]()
第Ⅱ卷(共77分)
三、(本题包括3小题,共32分)
22.(15分)实验室中用浓盐酸与![]() 反应制
反应制![]() ,再用
,再用![]() 和
和![]() 反应制少量漂白粉。已知
反应制少量漂白粉。已知![]() 与
与![]() 制漂白粉的反应是放热反应,温度稍高即发生副反应:6
制漂白粉的反应是放热反应,温度稍高即发生副反应:6 ![]() +6
+6![]() =
=![]() +5Ca
+5Ca![]() +6
+6![]() 。现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
。现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
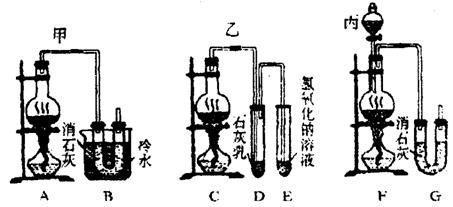
(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内。
a.不易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.容易污染环境 f.可防止污染环境
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(2)请从甲、乙、丙三套装置中,选择合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,其连接顺序(按气流从左到右方向)为:_________;在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,并说明原因:______________________________________________________________________________________________________________________________________________________________________________________________。
23.(6分)右图所示装置是化学实验中常见的仪器,它除用于洗气处,还有其它用途:
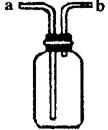
(1)医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装盛有水的该装置,用于观察气泡产生的情况,以便调节供氧速率,此时氧气应从________(填标号,下同)管口导入。
(2)实验室用![]() 与浓HCl反应制
与浓HCl反应制![]() 的实验中,在将生成的
的实验中,在将生成的![]() 通入NaOH溶液之前,先将
通入NaOH溶液之前,先将![]() 从该装置_________管口导进,从________管口导出。此时,该装置所起的作用是防止NaOH溶液倒流入反应器。
从该装置_________管口导进,从________管口导出。此时,该装置所起的作用是防止NaOH溶液倒流入反应器。
(3)当用此装置收集NO时,应采取的主要操作步骤是:
①______________________________________________________________;
②______________________________________________________________。
24.(11分)准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20 mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
| NaOH溶液起始读数 | NaOH溶液终点读数 | |
| 第一次 | 0.01Ml | 18.60mL |
| 第二次 | 0.20Ml | 18.00mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为______________mol/L。(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中![]() 反应产生少量
反应产生少量![]() ),测出的盐酸浓度__________(填“偏高”、“偏低”或“不变”)。
),测出的盐酸浓度__________(填“偏高”、“偏低”或“不变”)。
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是____________(填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?____________(填“是”或“否”)
四、(本题包括3小题,共26分)
25.(10分)A、B两种酸式含氧酸盐的相对分子质量均为120,且都溶于水;D、E均为无色气体:H是不溶于水和稀盐酸的白色沉淀。它们之间的转换关系如下图所示:
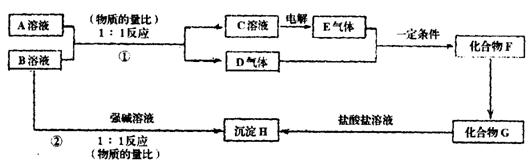
(1)A是___________,B是_____________(均写化学式)
(2)写出反应①和②的离子方程式
①___________________②________________________
(3)反应②发生后溶液的pH_______________7(填“>”、“<”或“=”)。
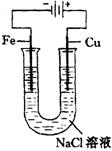
26.(6分)已知2NaCl+2![]()
![]() 2NaOH+
2NaOH+![]() ↑+
↑+![]() ↑,请画出一套能够实现反应Cu+2
↑,请画出一套能够实现反应Cu+2![]()
![]() Cu(OH)+
Cu(OH)+![]() ↑的装置简图。(图中须标明所用化学药品是何种物质)
↑的装置简图。(图中须标明所用化学药品是何种物质)
27.(10分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
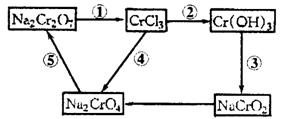
(1)在上述有编号的步骤中,需用还原剂的是______________,需用氧化剂的是_______________________(填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是___________(填化学式)。
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
□![]() +□KI+□HCl—→□
+□KI+□HCl—→□![]() +□NaCl+□KCl+□
+□NaCl+□KCl+□![]() +□_________
+□_________
28.(9分)血液中含葡萄糖(血糖)过高会引发糖尿病,低血糖,又会导致人易发生昏厥。正常人的血糖应为3.9mmo1/L—6.2mmol/L。某学生验血后得知其血糖的质量分数为0.1%。已知葡萄糖的相对分子质量为180,若血液的密度为1g/![]() ,则该学生血液中血糖的物质的量浓度是否符合正常人的范围?(通过计算回答)
,则该学生血液中血糖的物质的量浓度是否符合正常人的范围?(通过计算回答)
[注:1mmol=1×![]() mol]
mol]
29.(10分)某化工厂每小时生产98%(质量分数)硫酸at,为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体含氧的体积分数为b%。该空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,通过计算回答下列问题。
(1)该厂每小时消耗标准状况下的空气的体积为_____________![]() ;
;
(2)为了满足题设要求,b%的下限等于_____________。
高三基础知识检测(一)
答案
1—5 BACCB 6—1 1 CCDBC D 12—16 DCABC 1 7—21 BAACB
22.(15分)
(1)
| 优点 | 缺点 | |
| 甲装置 | d | a e |
| 乙装置 | f | a c |
| 丙装置 | b | c e |
(共9分)
(2)F B E;缺少除![]() 中所含
中所含![]() 的洗气装置,因为
的洗气装置,因为![]() 可与
可与![]() 及产物
及产物![]() 反应(每空3分,共6分)
反应(每空3分,共6分)
23.(6分)(1)a(2)b;a(3)①集气瓶中先充满水,②将NO从b管口导入[(1)、(2)、(3)各2分]
24.(11分)(1)0.15(2)不变(3)C(4)是[(1)、(2)、(3)各3分,(4)2分]
25.(10分)(1)![]() ;
;![]() (共4分)
(共4分)
(2)①![]() +
+![]()
![]()
![]() +
+![]() ↑;
↑;
②![]() +
+![]() +
+![]() +
+![]()
![]()
![]() ↓+
↓+![]() (共4分)
(共4分)
(3)>(2分)
26.(6分)见下图
27.(10分)(1)①;④(2分)(2)![]() (2分)
(2分)
(3)1 6
14 2 2
6 3 ![]() (4分)
(4分)
![]() (2分)
(2分)
28.(9分)
1L血液中含血糖的质量m=1g/mL×1000mL×0.1%=1g(4分)
血糖的物质的量浓度c=![]() =5.56×
=5.56×![]() mol/L(4分)
mol/L(4分)
该学生的血糖符合正常人标准(1分)
29.(10分)
解:(1)每小时生产纯![]() ∶n
∶n![]() =
=![]() (3分)
(3分)
设每小时消耗空气的体积为V
空气中![]() 的体积=反应中消耗
的体积=反应中消耗![]() 的体积+燃烧后混合气体中
的体积+燃烧后混合气体中![]() 的体积
的体积
V×21%=a×![]() ×22.4×
×22.4×![]() +V×b%
+V×b%
V=![]() (4分)
(4分)
(2)题干中“b的下限”是指燃烧后剩余![]() 在第2步氧化时恰好完全反应,燃烧前空气中
在第2步氧化时恰好完全反应,燃烧前空气中![]() 应恰好满足两步反应:
应恰好满足两步反应:
S+![]() =
=![]() 2
2![]() +
+![]() =2
=2![]()
两步反应耗氧量为2∶1,所以燃烧后混合气体![]() 的体积分数的下限为:
的体积分数的下限为:
b%=![]() ×21%=7%(3分)
×21%=7%(3分)