高三化学计算专题
【例题精讲】1.守恒法
例1 25.6 g铜粉跟一定量浓硝酸发生化学反应,当铜全部反应完毕时,生成的气体在标准状况下为11.2 L,此反应中消耗硝酸的质量为______g。
[思考] ①11.2 L为何种气体?
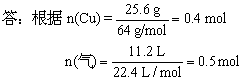
![]()
根据0.8 mol>0.5 mol,可知该气体应为NO与NO2的混合气体,(这是由于随着反应的进行,硝酸浓度逐渐减小所致。)
②试对该体系进行初、终态分析,并直接观察求解.
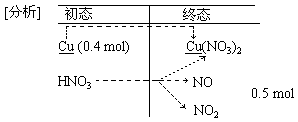
[解法1——微粒守恒法]
n(HNO3)=n[Cu(NO3)2]x2+n(NO)+n(NO2)
=0.4 mol×2+0.5
mol=1.3 mol
[思考] 若设所得气体分子组成为NOx,可否通过配平化学方程式求解?
[解法2——配平化学方程式法]
0.4Cu+y HNO3=0.4Cu(NO3)2+0.5NOx
y=0.8+0.5=1.3
2.巧设数据法
|
解析:由2NaHCO3
3.极植法:例3 取3.5克某二价金属的单质投入50克溶质质量分数为18.25%的稀盐酸中,反应结束后,金属仍有剩余;若2.5克该金属投入与上述相同质量、相同质量分数的稀盐酸中,等反应结束后,加入该金属还可以反应。该金属的相对原子质量为( )
A.24 B.40 C.56 D.65
解析:盐酸溶液中溶质的质量为50克×18.25%=9.125克,9.125克盐酸溶质最多产生H2的质量为![]() =0.25克。由题意知,产生1克H2需金属的平均质量小于3.5克×4=14克,大于2.5克×4=10克,又知该金属为二价金属,故该金属的相对原子质量小于28,大于20。答案选A。
=0.25克。由题意知,产生1克H2需金属的平均质量小于3.5克×4=14克,大于2.5克×4=10克,又知该金属为二价金属,故该金属的相对原子质量小于28,大于20。答案选A。
4.十字交叉法
例4 取100克胆矾,需加入多少克水才能配成溶质质量分数为40%的硫酸铜溶液?
解析:结晶水合物(CuSO4*5H2O)可看成CuSO4的溶液,其溶质质量分数为![]() ×100%=
×100%=![]() ×100%=64%。设加水(溶质质量分数可看成0%)的质量为x,则
×100%=64%。设加水(溶质质量分数可看成0%)的质量为x,则
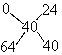
![]() x=60克
x=60克
5.估算法
例5 将13.2克可能混有下列物质的(NH4)2SO4样品,在加热的条件下,与过量的NaOH反应,可收集到4.3升NH3(密度为17克/22.4升),则样品中不可能含有的物质是( )
A.NH4HCO3、NH4NO3 B.(NH4)2CO3、NH4NO3
C.NH4HCO3、NH4Cl D.NH4Cl、(NH4)2CO3
解析:假设样品为纯(NH4)2SO4,则由(NH4)2SO4→2NH3可知,能产生4.48升NH3,大于4.3升。因此样品中的杂质造成样品NH4+的含量小于纯(NH4)2SO4中NH4+的含量。这就要求选项的两种物质中至少有一种物质的NH4+含量小于(NH4)2SO4中NH4+的含量,都大于是不可能的。可将备选答案化学式变形后进行估算:NH4HCO3→(NH4)2(HCO3)2,NH4NO3→(NH4)2(NO3)2,NH4Cl→(NH4)2Cl2.部分“式量”:(HCO3)=122,(NO3)2=124,Cl2=71,CO3=60,而(NH4)2SO4中,SO4=96,故答案选D。
6.差量法: 例6 4.0克+2价金属的氧化物与足量的稀盐酸反应后,完全转化为氯化物,测得氯化物的质量为9.5克,通过计算指出该金属的名称。
解析:反应后物质质量增加是由于参加反应氧化物的质量小于生成氯化物的质量。设金属氧化物化学式为RO,式量为m,
则RO→RCl2
质量增加
m
55
4.0克 (9.5-4.0)克
m=40。故金属的相对原子质量为40-16=24,属于镁元素。
【习题精练】
一.选择题
2、在一定温度下,将一包白色的无水硫酸铜粉未投入150克蒸馏水中充分搅拌并过滤,得到一定质量的蓝色晶体和84克滤液,若此温度下无水硫酸铜的溶解度为40克,则这包无水硫酸铜的质量是:
A 66克 B 184克 C 160克 D 90克
3、某氯酸钾样品中含有杂质氯化钾,其中氯元素质量百分含量为a%,则此氯酸钾样品的纯度为
A ![]() ×100% B
×100% B ![]() ×100%
×100%
C ![]() %
D 无法计算
%
D 无法计算
4、把a升含(NH4)2SO4和NH4NO3的混和溶液分成两等份,一份加入b mol烧碱并加热,恰好将全部NH4+转变成NH3放出;另一份需含c molBaCl2溶液恰能完全沉淀SO42-,则原溶液中NO3-的物质的的浓度是
A (2b-4c)/a摩/升 B (b-2c)/a摩/升 C (2b-c)/a摩/升 D (b-4c)/a摩/升
二.1-2项选择题
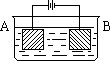 6、按右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68克,溶液质量增加0.03克,则A合金中Cu、Zn原子个数比为:
6、按右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68克,溶液质量增加0.03克,则A合金中Cu、Zn原子个数比为:
A 4︰1 B 3︰1 C 2︰1 D 任意比
7、实验室用100毫升0.10摩/升盐酸去滴定100毫升0.10摩/升NaOH溶液,如果允许滴定误差为±0.1%,则滴定终点时溶液的pH值范围是
A 5~8 B 3.3~10.7 C 4.3~9.7 D 4.4~10
8、现有pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH值接近于:
A a-lg2 B b-lg2 C a+lg2 D b+lg2
9、在373K时,把0.5摩N2O4气体通入为5升的真空密闭容器中,立即出现棕色,反应进行到2秒时,NO2的浓度为0.02摩/升,在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍,下列说法正确的是
A 前2 秒,以N2O4的浓度变化表示的平均反应速度为0.01摩/升·秒
B 在2秒时体系内压强为开始时压强的1.1倍
C 在平衡体系内含N2O4 0.25摩
D 平衡时,如果压缩容器体积,则可提高N2O4的转化率
10、饱和一元醛和酮的混和物共0.5摩尔,质量为40.4克,若此混和物发生银镜反应,可析出银43.2克,符合题意的组是
A 乙醛和丙酮 B 丙醛和丙酮 C 乙醛和丁酮 D 丙醛和丁酮
11、沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和H2O时,放出445kJ热量,则下列热化学方程式中正确的是:
A 2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) ΔH=+890kJ·mol-1
B CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890kJ·mol-1
C CH4(g)+4O2(g)=CO2(g)+2H2O(l) ΔH=-890kJ·mol-1
D 1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l) ΔH=-890kJ·mol-1
12、C8H18经多步裂化,最后完全转化为C4H8、C3H6、C2H4、C2H6、CH4五种气体的混合物。该混合物的平均相对分子质量可能是:
A 28 B 30 C 38 D 40
13、将0.2 mol/L的偏铝酸钠溶液和0.4 mol/L的盐酸溶液等体积混和,混和液中离子浓度由大到小的顺序正确的是
A [Cl-]>[Al3+]>[Na+]>[H+]>[OH-] B [Cl-]>[Na+]>[Al3+]>[H+]>[OH-]
C [Cl-]>[Al3+]>[Na+]>[OH-]>[H+] D [Na+]>[Cl-]>[Al3+]>[OH-]>[H+]
14、将m克Al2O3、Fe2O3的混和物溶解在过量的100毫升pH值为1的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100毫升,则NaOH溶液的浓度为:
A 0.1mol/L B 0.05mol/L C 0.2mol/L D 无法计算
18、不同的卤素原子之间能形成卤素互化物,其通式可表示为XX¢n(n=1、3、5、7)。这种卤化物大多数不稳定,易发生水解反应。如果BrFn跟水反应时物质的量之比为3︰5,生成溴酸、氢氟酸、溴单质和氧气,则下列叙述正确的是
A 此卤素互化物的分子式为BrF3
B 此卤素互化物的分子式为BrF5
C 每摩BrFn跟水完全反应可生成等物质量的Br2和O2
D BrFn的许多性质类似于卤素单质,有强的还原性
三、填空题
19、相同质量的乙醇、乙二醇、丙三醇。
(1)燃烧后生成二氧化碳的量由多到少的顺序 ;
(2)燃烧时消耗氧气的量由多到少的顺序 ;
(3)与足量金属钠反应放出氢气的量由多到少的顺序 。
20、在烃CnHm的分子结构中,若每减少2个氢原子,则相当于碳碳间增加一对共用电子。试回答下列问题:
(1)分子式为CnH2n+2的烃分子中碳碳间共用电子对数为 。
(2)分子式为CnH2n-6的烃分子中碳碳间共用电子对数为 。
 (3)Cx可看作是烃减氢后的产物,若某物质分子中碳碳间的共用电子对数为160。则符合该条件的碳单质的分子式为
;符合该条件的单烯烃的分子式为
。
(3)Cx可看作是烃减氢后的产物,若某物质分子中碳碳间的共用电子对数为160。则符合该条件的碳单质的分子式为
;符合该条件的单烯烃的分子式为
。
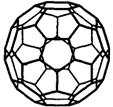
(4)目前,化学家们已经找到十余种富勒烯家族的Cx,它们分子结构中都由正五边形和正六边形构成的封闭的凸多面体,C60就是其中的一种富勒烯,其结构见右图。(3)小题中的Cx也是其中一种富勒烯。则问(3)Cx结构中五边形和六边形的个数分别是______和______。
(5)下列物质不属于富勒烯家族的有。
A C18 B C44 C C72 D C83
21、在常温下,有体积为m升、pH值为a的稀硫酸和pH值为b,体积为n升的烧碱溶液混和后,溶液呈中性。
(1)如果a+b=14,则m/n= (填数字)
(2)如果a+b=13,则m/n= (填数字)
(3)如果a+b>14,则m/n= (填含有A b的表达式),且m (填大于、小于或等于)
22、在某温度下,向某密闭容器中加入1摩尔氮气和3摩尔氢气,使之反应合成氨气,平衡后测得氮气的体积分数为m。若温度T不变,只改变起始加入量,使之反应平衡后氮气的体积分数仍为m。若氮气、氢气、氨气的加入量分别用X、Y、Z表示应满足:
(1)恒定T、V(体积)
A 若X=0、Y=0,则Z=
B 若X=0.75,Y= ,Z=
C X、Y、Z应满足的一般条件是
(2)恒定P(压强)、T
A 若X=0、Y=0,则Z
B 若X=0.75,则Y= ,Z
C X、Y、Z应满足的一般条件是
四、计算题
25、向某二价金属M的氢氧化物澄清溶液100毫升中加入过量的NaHCO3溶液生成MCO3沉淀,过滤,将沉淀置于足量盐酸中放出标准状态下的气体4.48升。将滤液加水稀释到250毫升,取出25毫升恰好与20毫升盐酸完全反应,并在标准状态下收集到1.12升气体。
(1)写出M的氢氧化物澄清溶液与NaHCO3溶液反应的化学方程式
(2)要计算金属M的相对原子质量,你认为还必须提供下列哪项数据?(填标号)
A M的氢氧化物的物质的量的浓度(设为2mol/L)
B M的碳酸盐的质量(设为39.4克)
C 与M的碳酸盐反应的盐酸的物质的量浓度
D 题给条件充足,不需要补充数据
(3)根据你的选择计算金属M的相对原子质量和加入NaHCO3溶液中NaHCO3的质量
26、由A、E、G三种元素组成的化合物的分子式为AxEyGz。已知:①x、y、z均是整数,且x+y+z=9 ②将3.1克该合物完全分解,化合物中A、E、G完全转化成气体A2E4和E2G ③将分解后的混和气体通过通入氢氧化钠溶液后,溶液增重1.7克 ④将剩余气体通入含有8克溴的溴水中恰好使溴水完全褪色 ⑤如果与④中相同的气体在氧气中完全燃烧,可生成AO2和E2O,AO2可使澄清石灰水变浑浊 ⑥该化合物中G的质量分数为51.6%,请填写下列空格:
(1)A、E、G三种元素的名称:A ,E , ;
(2)该化合物的分子式是 ;
(3)已知同族元素性质相似,推测该化合物可能的同分异构体的结构简式是(写结构简式) 和 。
参考答案
一、选择题
| 1 | 2 | 3 | 4 | 5 |
| A | B | B | A | D |
二、选择题
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| B | C | B | B | C | C | BC | B | A | C | AC | C | AC |
三、填空题
19、(1)乙醇、丙三醇、乙二醇 (2)乙醇、乙二醇、丙三醇 (3)丙三醇、乙二醇、乙醇
20、(1)n-1(2)n+3(3)C80 C160H320 (4)12 30 (5)A、D
21、(1)1 (2)0.1 (3)10a+b-14 大于
22、(1)A 2 B 2.25 0.5 C Y=3X X+Y+2Z=4 (2)A >0 B 2.05 ≥0 C Y=3X Z≥0
23、(1)① ③ (2)① (3)③ (4)② (5)③
24、(1)0.92(2)0.826 (3)Fe(Ⅱ)0.76Fe(Ⅲ)0.16O (4)正八面体 (5)3.03×10-10
四、计算题
25、(1)M(OH)2+2NaHCO3=MCO3↓+Na2CO3+2H2O (2)B (3)137,58.8克
26、(1)碳 氢 硫 (2)C2H6S (3)CH3CH2SH CH3-S-CH3