高三第一学期期中考试化学试卷
本试卷分为第Ⅰ卷和第Ⅱ卷两部分。满分150分。考试时间120分钟。
第Ⅰ卷 (共72分)
相对原子质量:C12;H1;Ca40;S32;O16;Fe56;Cu64;Ba137
一、选择题(本题共8小题。每小题4分共32分,只有一个正确选项。)
1、已知31g白磷变成红磷放出18.39kJ热量,下列两反应中:
4P(白、S)+5O2(g)=2P2O5(s),△H=Q1 kJ/mol
4P(红、S)+5O2(g)=2P2O5(s),△H=Q2 kJ/mol
则Q1和Q2的关系是:
A、Q1>Q2 B、Q1=Q2 C、Q1<Q D、无法确定
2、用已知浓度为98%的密度为1.84g/mL的浓硫酸,来配制质量分数为49%的硫酸溶液,试确定取用的98%的浓硫酸与水的体积比例:
A 大于1 B等于1 C 小于1 D无法确定
3、用氨水、苛性钠、盐酸中任何一种溶液作试剂都能被鉴别的溶液组是:
A、Al(NO3)3和AgNO3 B、Na2CO3和NaCl
C、Fe2(SO4)3和FeCl3 D、NH4Cl和MgCl2
4、化学不仅在书本里,化学还在生活中。比如厨房里常用小苏打去除砧板的鱼腥味,而残留的小苏打异味则应用下列物品去除( )
A、陈醋 B、食盐 C、味精 D、花生油
5、被誉为“太空金属”的钛,在室温下,不与水、稀盐酸、稀硫酸和稀硝酸作用,但易溶于氢氟酸,其原因可能是:
A、氢氟酸的酸性比其它酸强 B、氢氟酸的氧化性比其它酸强
C、氢氟酸的还原性比其它酸强 D、钛离子易与氟离子形成可溶性难电离物质
6、某电解质溶液的PH=a,向其中插入两惰性电极,通电一段时间测知溶液的PH=b,且b>a,该电解质可能是:
A、H2SO4 B、CuSO4 C、NaCl D、Na2SO4
7、已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→Cl-;HNO3→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是:
A、Fe3+ B、MnO4- C、Cl2 D、HNO3
8、类推的思维方式在化学学习与研究中是一种常用的方法,但是有时会产生错误的结论,因此,类推出的结论最终要经过实践的验证才能决定其正确与否。以下类推的结论正确的是( )
A、Na、Al具有强还原性,Na常温下与水剧烈反应,故Al也是
B、CO2是直线型非极性分子,故CS2、SiO2也是
C、实验室用浓硫酸与食盐共热得到HCl气体,故用浓磷酸也可以
D、由2Fe+3Cl2===2FeCl3可推出2Fe+3I2===2FeI3成立
二、选择题(本题共10小题,每小题4分共40分,每小题有一个或两个选项符合题意。)
9.设NA表示阿伏加德罗常数,下列说法正确的是( )
A、18克H2O中所含的原子总数为18NA
B、常温常压下,1mol氩气所含有的原子总数为NA
C、常温常压下,11.2L氧气所含的原子数为NA
D、常温下,0.5mol·L-1的NaCl溶液中Na+的浓度为0.5mol·L-1
10.下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是( )
A、Na+、Ba2+、Cl-、SO42- B、K+、AlO2-、NO3-、OH-
C、H+、NH4+、Al3+、SO42- D、H+、Cl-、CH3COO-、NO3-
11.关于化学键的下列叙述中,正确的是( )
A、离子化合物可能含共价键 B、共价化合物可能含离子键
C、离子化合物中只含离子键 D、共价化合物中不含离子键
12.一定条件下,可逆反应C(固)+CO2(气)![]() 2CO(气)+Q(Q>0)达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;
2CO(气)+Q(Q>0)达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;
④减少体系中CO的量;⑤增大反应体系的压强。上述措施中一定能使反应的正反应速率显著加快的是( )
A、①②③④⑤ B、①③④⑤ C、①②⑤ D、①③⑤
13.某NaOH溶液和0.1mol.L-1的HAc溶液充分混和后,若溶液呈中性,则该混合溶液中有关离子的浓度应满足的关系是( )
A、[ Na+ ]=[ Ac*] B、[ Na+ ]>[ Ac-]
C、[ Na+]<[ Ac-] D、[ Na+]+[ H+]=[ OH-]+[ Ac-]
14.能正确表示下列化学反应的离子方程式是
A 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B 金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C 硫化钠溶于水中:S2-+2H2O=H2S↑+2OH-
D 碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
15.已知醋酸的酸性强于苯酚,则相同温度、相同物质的量浓度的四种溶液:①苯酚钠 ②NaHSO4③CH3COONa④NaCl,按pH值由大到小的顺序排列,正确的是( )
A、①>②>③>④ B、④>③>②>① C、①>③>④>② D、③>①>④>②
16.同温同压下,取1 molA和1 molB按A(气)+aB(气)![]() C(气)进行反应,假定平衡时A的转化率为25%,且平衡混和气体的总量变为1.5mol,则a可能是( )
C(气)进行反应,假定平衡时A的转化率为25%,且平衡混和气体的总量变为1.5mol,则a可能是( )
A、a=1 B、a=2 C、a=3 D、a=4
17、在有乙离子存在的情况下,欲用试剂丙来检验溶液中是否含有甲离子,下表所加试剂丙能够对甲离子进行成功检验的是:(说明:在实验过程中不允许加热、过滤、萃取等操作)
| 选项 | 试剂丙 | 甲离子 | 乙离子 |
| A | 稀盐酸、Ba(NO3)2溶液 | SO42- | SO32- |
| B | AgNO3溶液 | Cl- | I- |
| C | KSCN溶液 | Fe3+ | Fe2+ |
| D | 稀氨水 | Al3+ | Ag+ |
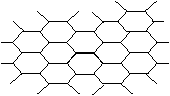 18、石墨晶体结构如下图所示:
18、石墨晶体结构如下图所示:
每一层由无数个正六边形构成,
则平均每个正六边所含的碳
原子数为:
A、6 B、4
C、3 D、2
第一学期期中考试
化学试卷
班级 学号 姓名 总分
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |
| 答案 |
| |||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | ||||||||||
第Ⅱ卷(非选择题 共78分)
三实验题(本题包括3小题,共31分)
19.(8分)把淀粉和NaBr溶液装入半透膜袋,多次浸入蒸馏水中进行分离。请问:
(1)该分离方法称为 。
(2)怎样证明淀粉未透过半透膜而Br-已经透过半透膜?(仪器、试剂任用)
(3)怎样证明淀粉与NaBr已经分离完全?(仪器、试剂任用)
20.(11分)有四支干燥的小试管中,分别装有少量白色物质(约占试管容积的1/10),已知该白色物质肯定是碳酸氢铵、碳酸氢钠、碳酸钠或氯化钠中的一种,现通过加热试管中样品和使用蒸馏水、石蕊试液或pH试纸进行鉴定。
(1)该实验的步骤与内容(略)
(2)请思考并填写下表:
| 白色物质 | 判断依据(现象) | 有关化学方程式(或离子方程式) |
| 碳酸氢铵 | ||
| 碳酸氢钠 | ||
| 碳酸钠 | ||
| 氯化钠 |
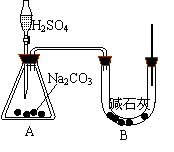 21(12分)、某同学拟在实验室进行“Na2CO3纯度的分析”实验,
21(12分)、某同学拟在实验室进行“Na2CO3纯度的分析”实验,
下面是他的实验过程:
他先设计如右图实验装置,其中A装置盛有无水Na2CO3
试剂(杂质不与水和酸反应)10.0g,分液漏斗内盛有稀硫酸,
![]()
![]() B装置内为碱石灰固体,根据碱石灰质量的增重可计算Na2CO3
B装置内为碱石灰固体,根据碱石灰质量的增重可计算Na2CO3
的纯度。他重复了三次正确操作,结果数据出现了较大偏差。
(1) 你分析出现较大偏差的原因:
。(设原容器内CO2气体的含量可忽略不计,各容器内反应完全。)
通过仔细分析,该同学又设计了一套实验装置(如图),可供选的试剂和药品还有:锌片、浓硫酸、氢氧化钠溶液,碳酸钙固体、蒸馏水。请回答下面问题:
(2)该同学重新设计的装置尚未完整,请在B或D虚框内画出需加上的装置图,并在右下角注明要用到的药品或试剂。
(3)A装置中分液漏斗所盛液体为 。A装置在整套装置中的作用是 。
(4)如果实验后E装置质量增重3.96g,则无水Na2CO3的纯度为 。

四、填空题(本题共3小题,共30分)
22、(9分)某可逆反应为A(气)+B(气)![]() 3C(气),下图中的甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的体积分数(φ)与反应时间(t)的关系。
3C(气),下图中的甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的体积分数(φ)与反应时间(t)的关系。
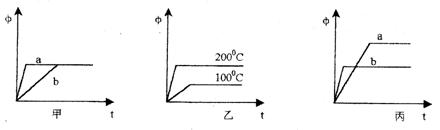
(1)若甲图中的a、b两条曲线分别表示有催化剂和无催化剂的情况,则曲线 表示的是无催化剂时的情况(催化剂一般是指正催化剂)。
(2)若乙图中的两条曲线分别表示在100℃和200℃时的情况,则可逆反应的正反应是
(选填吸热、放热)反应。
(3)若丙图中的a、b两条曲线分别表示在不同压强时的情况 ,则曲线 表示的是压强较大时的情况。
23.(10分)某温度(t℃)时,水的KW=10-13,则该温度应 (填写>、<或=)25℃,理由是 。将该温度下pH=11的aL NaOH溶液与pH=1的bL H2SO4溶液充分混合(忽略溶液体积变化),则有:
(1)若所得混合溶液为中性,则a:b ;
(2)若所得混合溶液的pH=2,则a:b 。
24、(11分)在一定条件下可实现下列物质间的转化,如下图所示:

①
②
(1) 固体A是一种可由石灰石来制取的重要工业原料,其化学式为: 。
(2) 写出反应①和②化学方程式:
①
②
(3) 上述变化中生成的C和过量的丙恰好能完全反应。该反应的化学方程式为
五、计算题(本题含2小题,共17分)
| 次序 | 稀盐酸(mL) | 余固体(g) |
| 1 | 先加入5.0mL | 1.32 |
| 2 | 再加入5.0mL | 0.64 |
| 3 | 再加入5.0mL | 0.20 |
| 4 | 再加入5.0mL | 0.20 |
26(7分)实验室有一种含有少量二氧化硅杂质的石灰石样品,某同学想准确测定该样品的纯度,他取用2.0g样品于烧杯中,把20.0mL稀盐酸分4次加入,充分作用后记录烧杯中固体质量表。请选择合适的数据并计算:
(1)该样品的纯度是多少?
(2)所取用的稀盐酸的物质的量浓度?
27.(10分)有一瓶(约100mL)硫酸和硝酸的混合溶液,量取10.00mL该混合溶液,加入足量的氯化钡溶液,充分反应后过滤、洗涤、烘干(忽略过程中的损失),可得到2.33g沉淀。将滤液用2.00ml L-1的NaOH溶液滴定,消耗35.00mL时达到滴定终点。请完成下列问题:
(1)写出上述实验过程中所有反应的化学方程式:
(2)通过计算确定原混合溶液中H2SO4和HNO3的物质的量浓度;
(3)另取10.00mL原混合酸溶液,加入1.60g铜粉充分作用后,无沉淀且溶液pH=2,计算在标况下生成的气体体积(不考虑气体的溶解和N2O4,溶液体积变化忽略不计)。