高三化学《化学反应速率 化学平衡》单元检测题
请将答案写在答题卷上
一、单项选择题(每题4分,共32分)
1、下列说法不正确的是( )
A、参加反应的物质的性质是决定化学反应速率的主要因素
B、光是影响某些化学反应速率的外界条件之一
C、决定化学反应速率的主要因素是浓度
D、使用正催化剂、升高温度、增大反应物浓度,都可以增大正反应速率
2、下列说法中正确的是( )
A、合成氨反应中使用催化剂,使原来不能发生的反应变为可以发生的反应了
B、增大压强对溶液间的反应速率几乎没有影响
C、温度升高,使放热反应速率增大,使吸热反应速率减小
D、如果反应是放热的,则反应开始时就不需要加热
3、NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成N2和CO2,对此反应下列叙述中正确的是( )
A、使用催化剂不能改变反应速率 B、降低压强能使反应速率加快
C、改变压强对反应速率没有影响 D、升高温度能加快反应速率
4、下列事实不能用勒沙特列原理解释的是( )
A、在氨水中加入盐酸时NH4+增多 B、打开啤酒瓶盖可以看到大量气泡冒出
C、高压有利于氨的合成 D、500℃左右比室温更有利于氨的合成
5、今有一充满NO2气体的密闭烧瓶,浸没在水中,要使瓶内气体的颜色变浅,可在水中加入的物质是( )
A、NaOH固体 B、浓硫酸 C、生石灰 D、NH4NO3晶体
6、在2SO2 + O2 ==== 2SO3 + Q的平衡体系中,下列条件可使逆反应速率加快,且平衡向右移动的是( )
A、升高温度 B、增大压强 C、增加SO3浓度 D、使用催化剂
7、在一定温度下H2(g)+I2(g) ==== 2HI(g)达到平衡的标志是( )
A、单位时间内生成n mol H2,同时生成n mol I2
B、容器内压强不随时间而变化
C、单位时间内生成2n mol HI,同时生成n mol I2
D、混合气体的平均分子量不随时间而变化
8、在密闭容器内发生反应2NO2(g) ==== N2O4(g),达到平衡后,能使容器内颜色变浅的是( )
A、将容器体积缩小一半 B、升高温度
C、将容器体积增大一倍 D、充入少量NO2
二、不定项选择题(有一个或者两个选项符合题意,每题4分,共20分)
9、在等温、等容条件下,有下列气体反应:2A(g) + 2B(g) ==== C(g) + 3D(g)。现分别从两条途径建立平衡:
I. A、B的起始浓度均为2 mol/L;
II.C、D的起始浓度分别为2 mol/L和6 mol/L。
下列叙述中正确的是( )
A、I、II两途径最终达到平衡时,体系内混合气的百分组成相同
B、I、II两途径最终达到平衡时,体系内混合气的百分组成不相同
C、达到平衡时I途径的VA等于II途径的VA
D、达到平衡后,第I途径混合气的密度和第II途径混合气密度相等
10、在一定条件下,向密闭容器中充入30 mL CO和20 mL H2O(g),使其反应,当
CO + H2O ==== CO2 + H2达到平衡后,H2O(g)的体积分数和H2相等,则下列叙述错误的是( )
A、平衡后CO的体积分数为40% B、平衡后CO的转化率为25%
C、平衡后水的转化率为50% D、平衡后混合气体的平均分子量为25
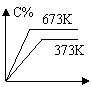
11、反应A(g) + B(g) ==== C(g) + D(g) – Q分别在673 K和373 K时进行,得到C的体积分数和时间t的关系曲线n、m,则能正确表示此反应的图象是( )
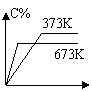 | 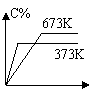 | 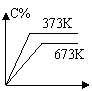 | |||||
 | |||||||
|
|
|
|
A B C D
12、HClO是比碳酸还弱的酸,当反应 Cl2 + H2O ==== HCl + HClO 达到平衡后,要使HClO的浓度增加,可以加入( )
A、Na2CO3固体 B、NaCl晶体 C、H2O D、CaCO3固体
13、在3NO2 + H2O ==== 2HNO3 + NO平衡体系中通入氧气,下列说法中正确的是( )
A、平衡向右移动 B、平衡向左移动
C、NO2的转化率提高 D、NO2的转化率减小
高三化学《化学反应速率 化学平衡》单元检测题
班级 姓名 学号 成绩 .
一、二选择题(共32+20=52分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 |
三、填空题(共38分)
14、可逆反应aA(g) + bB(g) ==== cC(g) + dD(g),取a mol A和b mol B置于V L容器中,1 min后,测得容器内A的浓度为x mol/L,这时B的浓度为 mol/L,C的浓度为 mol/L。这段时间内反应的平均速率若以物质A的浓度变化来表示应为 。(6分)
15、工业合成氨的适宜条件为:
温度 ;压强 ;使用 作为催化剂。(6分)
16、增大压强,化学平衡向着气体体积 (填“缩小”或者“增大”)的方向移动;降低温度,化学平衡向着 (填“吸”或者“放”)热方向移动;增大反应物浓度或者减小生成物浓度,都能使平衡向 (填“正”或者“逆”)反应方向移动;使用催化剂 (填“能”或者“不能”)改变化学平衡的移动,因为 。(6分)
17、(6分)在一定温度下,密闭容器中A + B ==== 2C类型的反应达到了平衡:
(1)当增加或减少A物质时,平衡不移动,则A物质的状态为 ;
(2)升高温度,平衡向右移动,此正反应是 热反应;升高温度时,正反应速率 了,逆反应速率 了(填“增大”或“减小”);
(3)若B物质为气态,增大压强时平衡不移动,则A物质为 态物质,C物质为 态物质。
18、合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔之前常用醋酸二氨合铜(I) 溶液来吸收原料气中的CO,其反应式为:
[Cu(NH3)2Ac] + CO + NH3 ==== [Cu(NH3)3]Ac•CO + Q
(1) 必须除去原料气中CO的原因是 。
(2)醋酸二氨合铜(I)吸收CO的生产适宜条件应是:
。
(3)吸收CO后醋酸铜氨溶液经过适当处理后又可以再生,恢复其吸收CO的能力以供循环使用。醋酸铜氨溶液再生的生产条件应是:
。(共2+3+3=8分)
19、工业上用氨和CO2合成尿素,已知下列物质在一定条件下均能与水反应产生H2和CO2,H2是合成氨的原料,CO2供合成尿素用。若从充分利用原料的角度考虑,选用 (填序号)物质做原料最好?(2+4=6分) A、CO B、石脑油(C5H12•C6H12) C、甲烷 D、焦炭
作出这种选择的理由是 。
四、计算题(10分)
20、在323K时,1体积SO2和3体积空气混合后发生反应:2SO2 + O2 ==== 2SO3,平衡时测得SO2的转化率为40%,求反应前后混合气体的密度比?
高三化学《化学反应速率 化学平衡》单元检测题
班级 姓名 学号 成绩 .
一、二选择题(共32+20=52分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | C | B | D | D | D | B | C | C | B | BD | C | AD | AC |
三、填空题(共38分)
14、可逆反应aA(g) + bB(g) ==== cC(g) + dD(g),取a mol A和b mol B置于V L容器中,1 min后,测的得容器内A的浓度为x mol/L,这时B的浓度为 mol/L,C的浓度为 mol/L。这段时间内反应的平均速率若以物质A的浓度变化来表示应为 。(6分)
15、工业合成氨的适宜条件为:
温度 ;压强 ;使用 作为催化剂。(6分)
16、增大压强,化学平衡向着气体体积 (填“缩小”或者“增大”)的方向移动;降低温度,化学平衡向着 (填“吸”或者“放”)热方向移动;增大反应物浓度或者减小生成物浓度,都能使平衡向 (填“正”或者“逆”)反应方向移动;使用催化剂 (填“能”或者“不能”)改变化学平衡的移动,因为 。(6分)
17、(6分)在一定温度下,密闭容器中A + B ==== 2C类型的反应达到了平衡:
(1)当增加或减少A物质时,平衡不移动,则A物质的状态为 ;
(2)升高温度,平衡向右移动,此正反应是 热反应;升高温度时,正反应速率 了,逆反应速率 了(填“增大”或“减小”);
(3)若B物质为气态,增大压强时平衡不移动,则A物质为 态物质,C物质为 态物质。
18、合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔之前常用醋酸二氨合铜(I) 溶液来吸收原料气中的CO,其反应式为:
[Cu(NH3)2Ac] + CO + NH3 ==== [Cu(NH3)3]Ac•CO + Q
(1) 必须除去原料气中CO的原因是 。
(2)醋酸二氨合铜(I)吸收CO的生产适宜条件应是:
。
(3)吸收CO后醋酸铜氨溶液经过适当处理后又可以再生,恢复其吸收CO的能力以供循环使用。醋酸铜氨溶液再生的生产条件应是:
。(共2+3+3=8分)
19、工业上用氨和CO2合成尿素,已知下列物质在一定条件下均能与水反应产生H2和CO2,H2是合成氨的原料,CO2供合成尿素用。若从充分利用原料的角度考虑,选用 (填序号)物质做原料最好?(2+4=6分) A、CO B、石脑油(C5H12•C6H12) C、甲烷 D、焦炭
作出这种选择的理由是 。
四、计算题(10分)
20、在323K时,1体积SO2和3体积空气混合后发生反应:2SO2 + O2 ==== 2SO3,平衡时测得SO2的转化率为40%,求反应前后混合气体的密度比?