高三化学测试题2
1.有以下四种物质:①FeCl2、Al(NO3)3、MgSO4、NH4NO3四种溶液;②C6H5OH、C6H5Br、C6H5-CH=CH2、C6H6四种液体;③NaCl、AlCl3、Ba(NO3)3、HCl四种溶液;④Fe、MnO2、CuO、C四种黑色固体。其中只用一种试剂(包括试纸,允许加热)就能把各组内物质区分开的是
A.只有①③ B.只有①②③ C.只有①③④ D.全部
2.在60℃恒温条件下,将200gA物质的溶液蒸发掉20g水后,析出10gA的无水晶体,再蒸发掉20g水后,又析出20gA的无水晶体,则原溶液中A的质量分数是
A.0.333 B.0.475 C.0.50 D.0.644
3.下列各组物质中,将前者加入后者,无论前者是否过量,都可以用同一个化学方程式表示的是
A.铜、三氯化铁溶液
B.稀硝酸溶液、偏铝酸钠溶液
C.稀盐酸、碳酸钠溶液
D.浓氨水、硝酸银溶液
4.工业上生产氯化钡的主要原料是重晶石,为使重晶石中的钡离子溶解,估计生产过程中,首先要使重晶石与下列哪种物质反应
A.盐酸 B. 硝酸 C. 炭粉 D.氯化钙
5.已知某溶液能跟铝反应放出氢气,该溶液中一定能大量共存的离子组是
A.Na+、NH4+、Cl—、CO32—
B.K+、Fe3+、Cl—、NO3—
C.K+、Ba2+、Br—、Cl—
D.K+、Na+、HCO3—、NO3—
6.一定条件下,8gA和17gB的混合气体体积为672mL,相同条件下,4gA和14gB的混合气体体积为448mL,可能是下列各组中的
A.乙烯和乙炔
B.甲烷和甲醇
C.乙炔和苯
D.环己烷和1—丁烯
7.有NaHS、MgSO4、NaHSO3组成的混合物,硫元素的质量分数为a%,则混合物中氧元素的质量分数为
A.a% B.2a% C.1-1.75a% D.1-0.75a%
8.用惰性电极电解M(NO)n的水溶液,当阴极上增重ag时,在阳极上析出bL氧气(标准状况),从而可知的相对原子质量是
A.22.4an/b B.11.2an/b C.5.6an/b D.2.5an/b
9.实验室有下列装置
 |  | ||||||
![]()
 | ||||||||||
A B C
下列试剂: ①一定浓度的氢氧化钠溶液 ②37%盐酸 ③40%硫酸 ④14%盐酸 ⑤大理石 ⑥碳酸钾固体
按下列要求填空:
⑴若要制取二氧化碳气体,应选用哪种装置 (填符号),选哪种试剂 (填代号),该装置检验气密性的方法是
,
有关的反应方程式是 。
⑵欲制备碳酸钠的纯溶液,应选择的试剂为 (填代号),简述实验步骤。
10.2000年在河南发现世界级特大金红石(含TiO2)矿床,这一发现具有重大战略意义,钛元素被称为21世纪的金属。
⑴钛元素的同位素有46 Ti、47 Ti、48 Ti、49 Ti、50 Ti,下列说法中正确的是( )
A. 钛的核内中子数比质子数多
B. 钛的相对原子质量为48
C. 钛在周期表中位于第四周期
D. 钛属于Ⅷ族元素
⑵TiO2是高级白色颜料,可用下列反应制得:
第一步:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O △H < O
第二步:TiOSO4+2H2O—TiO2•H2O+H2SO4 △H > O
制取TiO2关键是第二步,为使该步顺利进行,可采用 、 、 等措施。
⑶TiO2制成的纳米微粒对许多化学反应具有光催化作用,能吸收紫外线。 以下对TiO2纳米微粒的用途的说法中肯定不正确的是(只有一个选项符合题意) ( )
A.对有机物的废水进行处理
B.可制成抗菌防霉变的薄片
C.可制防晒霜
D.用于汽车尾气的净化处理
⑷最近发现一种钛、碳两种原子组成的气态团
![]() 簇分子,结构如图,这种分子的化学式为
。
簇分子,结构如图,这种分子的化学式为
。
|
|
|
| ||||
![]()
![]()
![]() [O]
[O]
催化剂
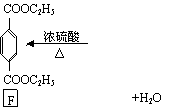
有机物E和F可用作塑料增塑剂或涂料的溶剂。它们的分子量相等,可以用下列方法合成:
| ||||
| ||||
|
|
|
|
|
|
|
|
|
|
 | |||||||
| |||||||
| |||||||
|
|
|
|
|
⑴写出有机物名称
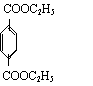 | |||
; .
⑵写出下列反应的化学方程式,并指出反应类型。
A + C → E 类型
CH2=CH2→D 类型
⑶E和F的相互关系属
①同一种物质 ②同一类物质 ③同系物 ④同分异构体
12.有下列转化关系:
|
|
|
|
|
|
|
⑴若C是可用做自来水消毒的气体,D、E是氧化物,D转化为E时增加氧的质量约是D物质总质量的25.8%,则A是 。
⑵若E是酸酐、且为易挥发的晶体,则A是 ,D转化为E的条件是 (用化学方程式表示)。
⑶若C是水,B是无氧化合物,且是同系物中相对分子质量最小的化合物,E能使紫色石蕊显红色,则A是 ,A、B、D、E中易溶于C的是
(用化学式表示)。
13.在标准状况下,1.68L某气体在足量O2中完全燃烧,若将产物通入足量澄清石灰水中,得到白色沉淀15.0g,若用足量碱石灰吸收燃烧产物,增重9.3g。
⑴产物中水的质量为 。
⑵若原气体是单一气体,则该气体的化学式为 。
⑶若原气体是两种等物质的量的气体的混合气体,其中只有一种是烃,则它们的分子式为 、 (只写一组)。
答案:1D 2B 3A 4C 5C 6B 7C 8C
9. ⑴A ④⑤ 将导管一端浸在水里,用手捂热试管,如果导管口有气泡冒出,证明装置不漏气。2HCl +CaCO3 == CaCl2 + H2O + CO2
⑵ ①④⑤ 步骤:①取同体积的氢氧化钠溶液分放在两只烧杯中;
②用14%的盐酸与大理石作用,将产生的CO2通入盛有氢氧化钠溶液的一只烧杯中,使之全部转化为碳酸氢钠;③将另一只烧杯中的氢氧化钠倒入其中,可得碳酸钠的纯溶液。
10.⑴ AC ⑵加热、加入NaOH溶液、及时将TiO2·H2O分离出去等。
⑶ C ⑷Ti14C13
11.⑴对二甲苯或1,4-二甲苯 对苯二甲酸酯
![]()
⑵HOH2C-![]() -CH2OH
+2CH3COOH CH3COOH2C-
-CH2OH
+2CH3COOH CH3COOH2C-![]() -CH2OOCCH3
-CH2OOCCH3
+2H2O 酯化反应
![]()
CH2=CH2 + H2O CH3CH2OH 加成反应
![]() ⑶
2、4
⑶
2、4
|
⑶C2H5OH; C2H5OH, CH3CHO, CH3COOH.
13.⑴ 2.7g ⑵ C2H4 ⑶CO,CH4