高等学校招生全国统一化学考试
第I卷(选择题,共72分)
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24
S 32 Ba 137
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.水资源非常重要,联合国确定2003年为国际淡水年。下列关于水的说法中错误的是
A 蒸馏法是海水淡化的方法之一
B 淡水的密度小于海水的密度
C 融化的雪水中矿物质含量比深井水中的少
D 0℃以上,温度越高,水的密度越小
2.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是
A NaOH B NH3·H2O C AgNO3 D BaCl2
3.下列除去杂质的方法正确的是
A 除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B 除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
4.浓度为0.50mol·L-1的某金属阳离子Mn+的溶液10.00mL,与0.40mol·L-1的NaOH溶液12.50mL完全反应,生成沉淀,则n等于
A 1 B 2 C 3 D 4
5.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A V1>V2>V3 B V1>V3>V2 C V2>V3>V1 D V3>V1>V2
6.质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)为
A ![]() B
B ![]()
C ![]() D
D ![]()
7.在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
A +4 B +5 C +6 D +7
8.等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1︰2︰3,则三种硫酸盐溶液的物质的量浓度比为
A 1︰2︰3 B 1︰6︰9 C 1︰3︰3 D 1︰3︰6
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.下列各分子中,所有原子都满足最外层为8电子结构的是
A H2O B BF3 C CCl4 D PCl5
10.下列有关纯铁的描述正确的是
A 熔点比生铁的低
B 与相同浓度的盐酸反应生成氢气的速率比生铁的快
C 在潮湿空气中比生铁容易被腐蚀
D 在冷的浓硫酸中可钝化
11.若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A Al3+ Na+ NO-3 Cl- B K+ Na+ Cl- NO3-
C K+ Na+ Cl- AlO2- D K+ NH+4 SO42- NO3-
12.对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是
A Br- B SO42- C H2SO3 D NH4+
13.能正确表示下列化学反应的离子方程式是
A 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B 金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C 硫化钠溶于水中:S2-+2H2O=H2S↑+2OH-
D 碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
14.设NA表示阿伏加德罗常数,下列叙述中正确的是
A 常温常压下,11.2L氧气所含的原子数为NA
B 1.8g的NH4+离子中含有的电子数为NA
C 常温常压下,48gO3含有的氧原子数为3NA
D 2.4g金属镁变为镁离子时失去的电子数为0.1NA
15.人们使用四百万只象鼻虫和它们的215磅粪物,历经30年多时间弄清了棉子象鼻虫的四种信息素的组成,它们的结构可表示如下(括号内表示④的结构简式)
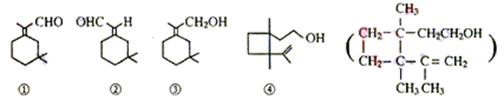
以上四种信息素中互为同分异构体的是
A ①和② B ①和③ C ③和④ D ②和④
16.用惰性电极实现电解,下列说法正确的是
A 电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
17.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是
A 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B 甲烧杯中的酸过量
C 两烧杯中参加反应的锌等量
D 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
18.将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A [HCN]<[CN-] B [Na+]>[CN-]
C [HCN]-[CN-]=[OH-] D [HCN]+[CN-]=0.1mol·L-1
第II卷(非选择题,共78分)
三、(本题包括2小题,共22分)
19.(7分)(1)无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸。答:
(2)要配制浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是 (填代号)。
A 称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B 称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
C 称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D 用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
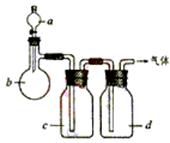 20.(15分)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
20.(15分)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
| 气体 | a | b | c | d |
| C2H4 | 乙醇 | 浓H2SO4 | NaOH溶液 | 浓H2SO4 |
| Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓H2SO4 |
| NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
| NO | 稀HNO3 | 铜屑 | H2O | P2O5 |
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体 ,理由是 。
②气体 ,理由是 。
③气体 ,理由是 。
④气体 ,理由是 。
四、(本题包括2小题,共18分)
21.(6分)周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1:2。写出这些化合物的化学式 。
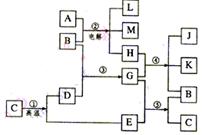 22.(12分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
22.(12分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
(1)单质L是 。
(2)化合物B是 。
(3)图中除反应①以外,还有两个用于工业生产的反应,是 和 (填代号)。
它们的化学反应方程式分别是 和 。
五、(本题包括2小题,共18分)
23.(10分)A是一种含碳、氢、氧三种元素的有机化合物。已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%;A只含有一种官能团,且每个碳原子上最多只连一个官能团:A能与乙酸发生酯化反应,但不能在两个相邻碳原子上发生消去反应。请填空:
(1)A的分子式是 ,其结构简式是 。
(2)写出A与乙酸反应的化学方程式: 。
(3)写出所有满足下列3个条件的A的同分异构体的结构简式。①属直链化合物;②与A具有相同的官能团;③每个碳原子上最多只连一个官能团。这些同分异构体的结构简式是 。
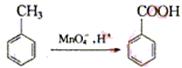
24.(8分)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基,例如
化合物A—E的转化关系如图1所示,已知:A是芳香化合物,只能生成3种一溴化合物,B有酸性,C是常用增塑剂,D是有机合成的重要中间体和常用化学试剂(D也可由其他原料催化氧化得到),E是一种常用的指示剂酚酞,结构如图2。写出A、B、C、D的结构简式:
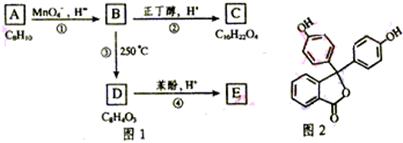
A:
B:
C:
D:
六、(本题包括2小题,共20分)
25.(8分)取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00mol·L-1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol·L-1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00ml·L-1盐酸恰好完全中和。计算混合物中各物质的质量。
26.(12分)I.恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(气)+B(气)![]() C(气)
C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
参考答案
一、(本题包括8小题,每小题4分,共32分)
1.D 2.A 3.C 4.A 5.B 6.C 7.B 8.B
二、(本题包括10小题)
9.C 10.D 11.B 12.B 13.A 14.BC 15.C 16.D 17.AC 18.BD
三、(本题包括2小题,共22分)
19.(1)略 (2)A、D
20.(1)NO
(2)①C2H4 装置中没有温度计,无法控制反应温度
②Cl2 反应生成的Cl2被c中的NaOH溶液吸收了
③NH3 反应生成的NH3被c中的H2O吸收了
四、(本题包括2小题,共18分)
21.Na2O, K2S, MgF2, CaCl2
22.(1)H2 (2)H2O (3)②,④
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
2Ca(OH)2+2Cl2=Ca(OCl)2+CaCl2+2H2O
五、(本题包括2小题,共18分)
23.(1)C5H12O4 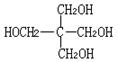
(2)C(CH2OH)4+4CH3COOH![]() C(CH2OCCH3)4+4H2O
C(CH2OCCH3)4+4H2O
(3)CH3![]()
![]()
![]() CH2OH HOCH2CH2
CH2OH HOCH2CH2![]()
![]() CH2OH HOCH2
CH2OH HOCH2![]() CH2
CH2![]() CH2OH
CH2OH
24.(1)![]() (2)
(2)![]()
(3)![]() (4)
(4)![]()
六、(本题包括2小题,共20分)
25.混合物中Na2SO4的质量=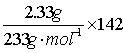 g·mol-1=1.42g
g·mol-1=1.42g
设混合物中Na2CO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量=![]() =0.0900mol 与Na2CO3、NaHCO3反应的盐酸的物质的量为
=0.0900mol 与Na2CO3、NaHCO3反应的盐酸的物质的量为
0.250L×1.00mol·L-1-0.500L×0.100mol·L-1×2+0.0100L×1.00 mol·L-1=0.160mol
![]()
解得:x=0.0700mol y=0.0200mol
Na2CO3质量=0.0700mol×106g·mol-1=7.42g
NaHCO3质量=0.0200mol×84g·mol-1=1.68g
26.(1)(1-a) (2)3a (3)2 3-3a 丁
若3a>1,B的物质的量小于2mol;若![]() ,B的物质的量等于2mol;
,B的物质的量等于2mol;
若3a<1,B的物质的量大于2mol
(4)![]()
(5)乙 因为(5)小题中容器容积不变,而(1)小题中容器的容积缩小,所以(5)小题的容器中的压力小于(1)小题容器中的压力,有利于逆向反应,故反应达到平衡后a>b。
中学综合学科网整理编辑