高考化学单元测试(十二) 电化学 胶体
(时间90分钟 满分100分)
班级 学生姓名 得分
可能用到的相对原子质量:H:1 O:16 S:32 Cu:64 Ag:108
第Ⅰ卷(选择题,共40分)
一、选择题(本小题包括8小题,每小题2分,共16分。每小题只有一个选项符台题意。)
1.下列叙述中不正确的是
A.烟水晶是固溶胶
B.烟雾都有丁达尔效应
C.江河入海口易产生沉积小岛是胶体遇海水发生聚沉的缘故
D.渗析可用来分离胶体和浊液
2.向某分散系中加入少量稀硫酸后振荡,有浑浊现象。原分散系不可能是
A.Fe(NO3)3溶液 B.AgI胶体 C.Na2S2O3溶液 D.Ba(HCO3)2溶液
3.用惰性电极电解下列物质的稀溶液,经过一段时间后,溶液的pH值减少的是
A.H2SO4 B.NaOH C.NaCl D.NaNO3
4.铁棒与石墨用导线连接后,浸入0.01mol/L的食盐溶液中,可能出现的现象是
A.铁棒附近产生OH— B.铁棒被腐蚀
C.石墨棒上放出Cl2 D.石墨棒上放出O2
5.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A.利用电池外壳的金属材料
B.回收其中的石墨电极
C.防止电池中的汞、镉和铅等重金属离子对土壤和水源的污染
D.不使电池中渗泄的电解液腐蚀其他的物品
6.下列叙述正确的是
①锌与稀硫酸反应制取氢气,加入少量硫酸铜能加快反应速率
②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③电镀时,应把镀件置于电解槽的阴极
④钢铁表面常易锈蚀生成Fe2O3·H2O
A.①②③④ B.①②④ C.①③④ D.②④
7.日常所用的干电池其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2做电解质(其中加入MnO2氧化吸收H2),电极反应可简化为:Zn-2e—=Zn2+(NH3再用于结合Zn2+)。根据上述叙述,判断下列说法中正确的是
A.干电池中锌为正极,碳为负极
B.干电池可以实现化学能向电能的转化和电能向化学能的转化
C.干电油工作时,电子由碳极经外电路流向锌极
D.干电池长时间连续使用时内装糊状物可能流出腐蚀电路
8.用质量均为10.00g的铜板做电极,电解AgNO3溶液,当诫电极的质量差为2.80g时,则两电极的质量分别是
A.阳极9.36g 阴极12.16g
B.阳极8.60g 阴极11.40g
C.阳极10.00g 阴极12.80g
D.阳极12.80g 阴极l0.00g
二、选择题(本小题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该髓为0分;若正确答案只包括两个选项,只选一个且正确的给2分,选两个且都正确的给3分,但只要选错一个,该小题就为0分)
9.欲加快铜与硝酸反应速率,可采用不同的措施,若采用化学试剂法,下列试剂中可以使用的是
A.蒸馏水 B.无水醋酸钠
C.石墨 D.AgNO3溶液(少量)
10.以下现象与电化腐蚀无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌长期放置后在其奖牌的表面变暗
11.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可表示为:
2Ag+Zn(OH)2 Ag2O+Zn+H2O
在此电池放电时,负极上发生反应的物质是
A.Ag Zn(OH)2 C.Ag2O D.Zn
12.阿波罗宇宙飞船使用的氢氧燃烧电池,其总反应为:2H2+O2+H2O,电解液为KOH溶液,反应保持在较高温度使生成的水蒸发,下列叙述正确的是
A.能见到浅蓝色的火焰
B.H2为正极,O2为负极
C.工作时电解液的pH值下降
D.负极反应式为2H2+4OH--4e-=4H2O
13.FeCl3溶液和Fe(OH)3胶体共同具备的性质是
A.分散质微粒都能透过半透膜
B.用石墨电极做导电性实验时,分散质微粒都定向且朝一个方向移动
C.都有丁达尔现象
D.都比较稳定
14.燃烧电池是燃料(如CO、H2、CH4等)跟氧气(或空气)起反应将化学能转化为电能的装置,电解质溶液是强碱(如KOH)溶液,下面关于甲烷燃烧电池的说法不正确的是
A.正极反应式为O2+2H2O+4e—=4OH—
B.负极反应式为CH4+10OH——8e—=CO32—+7H2O
C.随着放电的进行,溶液的pH值不变
D.甲烷燃烧电池的能量利用率比甲烷燃烧的大
15.用石墨做电极,电解氯化铜和氯化钠的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是
A.阴极:2H++2e—=H2↑ 阳极:4OH——4e—=2H2O+O2↑
B.阴极:2H++2e—=H2↑ 阳极:2Cl——2e—=Cl2↑
C.阴极:Cu2++2e—=Cu 阳极:4OH——4e—=2H2O+O2↑
O.阴极:Cu2++2e—=Cu 阳极:2Cl——2e—=Cl2↑
16.有a,b,c三个电解槽,a中盛有CuSO4溶液,用铜作电极,b和c两槽均盛有AgNO3溶液,用银作电极,先将a、b并联后再与c串联进行电解.若在b中银阴极增重0.108g,c中银阳极减重0.216g时,对于a中的铜阴极和阳极的正确叙述是
A.铜阴极增重0.064g B.铜阴极增重0.032g
C.铜阳极析出气体0.08g D.铜阳极析出气体0.16g
第Ⅱ卷(非选择题,共60分)
三、(本题包括2小题,共15分)
17.(6分)分别设计化学实验,用最佳方法证明硫酸铁溶于水时发生的下列变化:供选用的药品和仪器:硫酸铁溶液、甲基橙溶液、石蕊试液、酚酞试液、pH试纸、氢氧化钠溶液、酒精灯、玻棒、半透膜、电泳仪、聚光束仪。
(1)证明硫酸铁发生了水解反应: 。
(2)证明其水解反应是一个吸热反应: 。
(3)证明水解以后生成了胶体溶液: 。
(4)证明氢氧化铁胶体微粒带正电荷: 。
18.(9分)一位同学使用①冷开水、②碘酒、③熟石灰、④淀粉、⑤肥皂水、⑥食醋、⑦红墨水、⑧废易拉罐(铝合金)、⑨废干电池(锌筒里装填有碳粉、二氧化锰、氯化铵、淀粉等物质的糊状混合物)、⑩食盐、⑩纯碱为实验试剂,进行家庭小实验。
(1)用给定的试剂,不能进行的实验是(不考虑电解) (填写序号)。
a.制NaOH溶液 b.制备纯净氧气,并实验它的漂白作用
c.实验硬水和肥皂的作用。 d.制二氧化碳
e.制硬脂酸 f.进行淀粉水解实验,并检验水解产物。
(2)该同学为制备氨气,先从废干电池中制备氯化铵。为此,他准备把废干电池锌筒里的糊状混合物溶解于少量水,过滤,除去不溶物,再蒸发、灼烧滤液,以制得干燥的氯化铵晶体。他的设想 (填“合理”或“不合理”),理由是 。
(3)该同学拟进行除去淀粉溶液中所含食盐的实验。他把一个鸭蛋浸泡在食醋里,待蛋壳溶去,在膜上打一小洞,小心倒出蛋清、蛋黄、洗净蛋膜,作为半透膜小袋,再装入含食盐的淀粉溶液,扎好袋口。做好这些准备工作后,他即将进行的实验操作名称是 (填“萃取”、“盐析”、“渗析”、“过滤”“分液”)。要保证全部除去淀粉溶液里的食盐,实验中必须 。食醋溶去蛋壳发生反应的离子方程式是 。
四、(本题包括2小题,共15分)
19.(6分)烧过菜的铁锅未及时洗净(溶液中含NaCl),第二天便出现红棕色锈斑(Fe(OH)3失水产物),试写出有关电极反应式,离子、总化学方程式
(1)负极 ;
(2)正极 ;
(3)离子方程式: ;
(4)总化学方程式 。
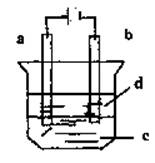 20.(9分)由于Fe(OH)2极易被氧化。所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示的电解实验可制得白色纯净的Fe(OH)2沉淀,两电极的材料分别是石墨和铁。
20.(9分)由于Fe(OH)2极易被氧化。所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示的电解实验可制得白色纯净的Fe(OH)2沉淀,两电极的材料分别是石墨和铁。
(1)a电极材料应为 ,电极反应式为
(2)电解液C可以是 。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是 ,在加入苯之前对C应作何简单处理
(4)为了在较短时间内看到白色沉淀,可采用的措施是 。
A.改用稀硫酸做电解液 B.适当增大电源的电压
C.适当减小两电极距离 D.适当降低电解液的温度
(5)若c用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象是 。
五、(本题包括2小题,共15分)
21.(7分)工业上采用以铁和石墨为电极,电解K2MnO4溶液制取KMnO4。
(1)电解时,应以 作阴极,电解过程中,阴极附近溶液的pH值将会 (增大、减少、保持不变)。
(2)阳极的反应为 。
(3)电解的总化学反应方程式为:
22.(8分)阿伏加德罗常数(NA)、物质的量(n)和粒子数(N)之间有如下关系:NA=N/n,测定阿伏加德罗常数有多种方法,其中电解法(根据电子的物质的量和电子数来测定NA)是常用的方法,试回答下列有关问题.
(1)实验室有相同浓度的NaCl、CuSO4、AgNO3、H2SO4等溶液,若实验过程中用惰性电极电解,且不考虑电极上的析出物与电解质溶液之间的反应,则你认为选用哪一种溶液作为电解液,实验既简便,测定结果误差又小,并说明理由。
(2)采用你所选定的溶液来实验,至少应测定 个数据,它们是
(3)若已知1个电子的电量(符号为q),选定符号代表有关数据,列出“电解法”求算阿伏加德罗常数(NA)的数学表达式。
六、(本题包括2小题,共15分)
23.(7分)常温下,将分别盛有100mL的KCl溶液、Na2SO4溶液、CuSO4溶液的三个电解槽(电极均为惰性电极)串联,然后通直流电进行电解。当某电极析出0.32g铜后,即停止反应,(假定各溶液在电解前后的体积不变),这时三个电解槽中溶液的pH分别是多少?
24.(8分)将1L一定浓度的CuSO4溶液,用a,b两个石墨作电极电解,当a极上产生22.4L(标准状况)气体时,b极上有金属析出,然后将a,b极电源反接,继续通直流电,当b极上又产生22.4L(标准状况)气体时,溶液质量共减少227g。
求:
(1)a极上产生22.4L(标准状况)气体时,b极增加的质量。
(2)求原溶液的物质的量浓度。
1.D 2.A 3.A 4.B 5.C 6.C 7.D 8。A 9.CD 10.D 11.D 12.D 13.D 14.C 15.C 16.B
17.(1)用PH试纸测硫酸铁溶液,PH<7,证明溶液呈酸性,硫酸铁发生水解(2分)
(2)加热溶液,用PH试纸测溶液的PH值,PH值减小,证明水解反应是一个吸热反应(1分)
(3)用聚光束仪的光束照射溶液,产生了丁达尔现象,证明形成了胶体溶液(1分)
(4)用电泳仪进行电泳,一段时间后,阴极附近颜色加深,证明氢氧化铁胶体微粒带正电。(2分)
18.(9分)(1)bf(2分)
(2)不合理;([分),滤液中含有淀粉,灼烧时,淀粉炭化,氯化铵分解(2分)
(3)渗析(1分)不时更换渗析用的蒸馏水,直至渗析后的蒸馏水中不再检出Cl—(1分),CaCO3+ 2CH3COOH=Ca2++2CH3COO—+CO2↑+H2O(1分)
19.(6分)(1)Fe—2e—=Fe2+ (1分)
(2)2H2O+O2 +4e—=4OH— (1分)
(3)Fe2++2OH—=Fe(OH)2↓
4Fe(OH)2+O2 +2H2O=4Fe(OH)3↓ (2分)
(4)4Fe+3O2 +6H2O=4Fe(OH)3↓ (2分)
20.(1)Fe Fe—2e—=Fe2+(2分)
(2)BC(2分)
(3)隔绝空气,防止氧化,加热赶走其中的空气(2分)
(4)BC(1分)
(5)白色沉淀,迅速变成灰绿色,颜色逐渐加深至深红褐色(1分)
21.(1)Fe、增大(3分)
![]() (2)MnO42——e—=MnO4—(2分)
(2)MnO42——e—=MnO4—(2分)
(3)2K2MnO4+2H2O 2KMnO4+2KOH+H2↑(2分)
22.(1)选用AgNO3 溶液较好(2分)
①若电解NaCl、H2SO4 溶液,产生的气体体积较难测定准确。(1分)
②若同样的条件下,通过等量的电量,析出Ag的质量大于Cu,因而称量和计算时产生的误差前者要小。(1分)
(2)3,①电流强度 ②电解(通电)时间 ③电解产物的质量(2分)
(3)![]() (2分)
(2分)
(说明:I:电流强度,t:通电时间 m(Ag):析出Ag的质量 M(Ag):Ag的摩尔质量)
23.由题意可知
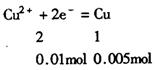 |
∴整个串联三个电解槽中电子转移为0.0lmol(1分)
①对于KCl n(OH—)=n(e—)=0.01mol
C(OH—)=0.1mol/L PH=13 (2分)
②对于K2SO4 PH=7(2分)
③对于CuSO4 n(H+)=n(e—)=0.01mol
C(H+)=0.1mol/L pH=1(2分)
24.(1)电解CuSO4 :2Cu~O2
2 1
2mol lmol (1分)
m(Cu)=64×2=128g (2分)
(2)反接后前一段时间为电镀,溶液质量共减轻160g。
电镀完成后若仍为电解CuSO4 则lmol O2析出,则溶液还会损失160g(1分)
∴后阶段应有H2 析出
设溶液中在电镀完成后仍有x molCuSO4和Ymol水电解.
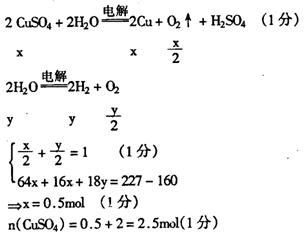 |
∴b极增重128g,原溶液的浓度为2.5mol/L