高考化学仿真试题(一)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分,考试时间120分钟。
第Ⅰ卷(选择题 共74分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型(A、B)用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束后,考生将本试卷和答题卡一并交回。
一、选择题(本题包括8小题,每小题3分,共24分;每小题只有一个选项符合题意)
1.下列有关厨房铝制餐具的使用,你认为合理的是
A.盛放食醋 B.烧煮开水
C.用金属丝擦污垢 D.用碱水洗涤
2.由两种原子组成的某种物质
A.一定是化合物 B.可能是化合物或单质
C.一定是单质 D.一定是同素异形体
3.与甲烷具有相等的质子数和电子数的组合是
①F- ②H2O ③NH3 ④— OH ⑤NH![]() ⑥HF
⑦OH-
⑧H3O+
⑨Mg2+
⑥HF
⑦OH-
⑧H3O+
⑨Mg2+
A.全部 B.②③⑥ C.①④⑦⑨ D.⑤⑧
4.下列物质的化学式与俗称完全正确的是
①Na2CO3——小苏打 ②NaOH——纯碱 ③Na2SO4·10H2O——芒硝
④FeSO4·7H2O——绿矾 ⑤
A.①②③ B.①③⑤ C.②③④ D.③④⑤
5.将铁棒与石墨用导线连接后,浸入0.1 mol·L-1的食盐溶液中,可能出现的现象是
A.铁棒附近产生OH- B.铁棒被腐蚀
C.石墨棒上放出 Cl2 D.石墨棒上放出O2
6.要使Ba2+、Al3+、Cu2+、Mg2+、Ag+五种离子从溶液中逐一沉淀出来,选用试剂及加入顺序正确的是
A.Na2SO4→HCl→H2S→NaOH→CO2 B.HCl→H2SO4→H2S→NaOH→CO2
C.Na2S→Na2SO4→NaCl→NaOH→CO2 D.NaCl→Na2SO4→NaOH→H2S→CO2
7.我国三峡工程所提供的清洁、廉价、可再生的水电,相当于每年燃烧3×107 t原煤的火力电厂产生的电能。三峡工程有助于控制
A.温室效应 B.氮的氧化物排放
C.白色污染 D.碳氢化合物排放
8.下列叙述正确的是
A.两种元素构成的共价化合物分子中的化学键都是极性键
B.两种元素原子间形成的化学键都是极性键
C.含有极性键的化合物就一定是极性分子
D.只要是离子化合物,其熔点就比共价化合物高
二、选择题(本题包括10小题,每小题5分,共50分;每小题有一个或两个选项符合题意)
9.除去鸡蛋白溶液中少量的葡萄糖杂质,可采用的方法是
A.过滤 B.渗析 C.盐析 D.萃取分液
10.下列离子方程式正确的是
A.将Fe放入稀硫酸中 2Fe+6H+====2Fe3++3H2↑
B.Ca(HCO3)2溶液中加入盐酸 HCO![]() +H+====CO2↑+H2O
+H+====CO2↑+H2O
C.向FeCl2溶液中通入Cl2 Cl2+Fe2+====Fe3++2Cl-
D.Na2S水解 S2-+H2O====H2S↑+2OH-
11.把3 mol A 和2.5
mol B 混合于2 L密闭容器中,发生反应的化学方程式为:3A(g)+3B(g)![]() x
C(g)+z D(g),5 min后反应达平衡,容器压强变小,已知D的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是
x
C(g)+z D(g),5 min后反应达平衡,容器压强变小,已知D的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是
A.达到平衡时,B的转化率为25%
B.达到平衡时,C的浓度为0.125 mol/L
C.A的平均反应速率为0.15 mol·L-1·min-1
D.达到平衡时,容器压强为原来的0.8倍
12.在0.1 mol/L的Na2S溶液中,下列关系中正确的是
A. c(Na+)>2c(S2-)>2c(HS-)>2c(OH-)
B. c(OH-)=c(H+)+c(HS-)+2c(H2S)
C. c(S2-)+c(HS-)+c(H2S)=0.2 mol/L
D. c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-)
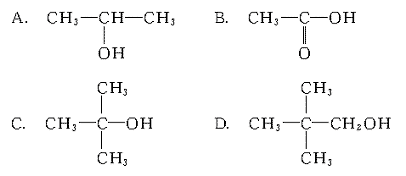
13.在下列各种有机化合物中,既能发生取代反应,又能发生消去反应的是
14.四种主族元素的离子下标aXm+,bYn+,cZn-和dRm-(a、b、c、d)为元素原子序数,它们具有相同的电子层结构,若m>n,下列叙述正确的是
A.a-b=n-m B.元素的原子序数a>b>c>d
C.元素非金属性Z>R D.最高价氧化物对应水化物碱性x>y
15.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象均相同的是
A.NaHSO4和Ba(OH)2 B.AlCl3和NaOH
C.NaAlO2和H2SO4 D.Ba(HCO3)2和Ba(OH)2
![]() 16.若以乙醇为原料通过两步反应合成
制取过程中发生的有机反应类型是
16.若以乙醇为原料通过两步反应合成
制取过程中发生的有机反应类型是
A.消去反应和缩聚反应 B.取代反应和加聚反应
C.消去反应和加聚反应 D.水解反应和加聚反应
17.“过氧化氢”(H2O2)被称为“绿色漂白剂”,下列叙述中不正确的是
A.H2O2分子中含有O2-
B.纯H2O2是一种淡蓝色粘稠液体,能与水以任意比例混合
C.H2O2常用作医用消毒剂
D.在酸性溶液中H2O2是强氧化剂,而还原性较弱
18.锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗元素处于它的最高价态,铋元素的价态与它跟氯形成某种化合物的价态相同,且此氯化物中铋具有8电子稳定结构,BGO的化学式可能是
A.Bi3Ge3O13 B.Bi4Ge3O12 C.Bi4Ge3O16 D.Bi3Ge3O12
第Ⅱ卷(非选择题 共76分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试题卷中。(除题目有特殊规定外)
2.答卷前将密封线内的项目填写清楚。
| 题 号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 分 数 |
| 总 分 |
三、(本题包括2小题,共22分)
19.(10分)利用图1—1收集以下气体:①H2;②Cl2;③CH4;④NO;⑤SO2
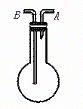 (1)若烧瓶是干燥的,则由A口进气,可收集的气体是
;由B口进气,可收集的气体是
。
(1)若烧瓶是干燥的,则由A口进气,可收集的气体是
;由B口进气,可收集的气体是
。
(2)若烧瓶内充满水,可收集到的气体是 ,气体由
口进入。(填A或B)
(3)若烧瓶内装有一定量的溶液,用来洗气,则气体应由 口进入。(填A或B)
(4)若该装置用作气体的贮气瓶,充满甲烷气体。使用时,除保证装置气密性外,可在端口 处接自来水。
20.(12分)实验室用浓盐酸、MnO2共热制取Cl2,并用Cl2和Ca(OH)2 图1—1
反应制少量漂白粉。已知反应:2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O,
温度稍高时即发生6Cl2+6Ca(OH)2====5CaCl2+Ca(ClO3)2+6H2O这一副反应,现在有三个同学分别设计的三套实验装置如图1—2所示:
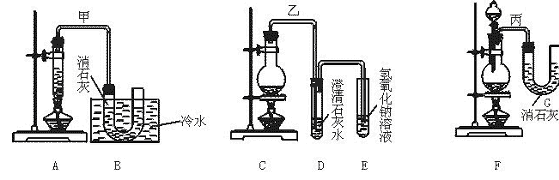
图1—2
(1)按下列几项优缺点,请你做出评价,选择符合题目要求的选项填在下表空格内。
a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可防止副反应发生;e.污染环境;f.可防止污染环境。
| 优点 | 缺点 | |
| 甲装置 ① | ||
| 乙装置 ② | ||
| 丙装置 ③ |
(2)图示装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成。请从图A~G各部分装置中选择合理的组成部分,组装成一套较完善的实验装置,该装置各部分的连接顺序(按气流由左到右方向)是 。
(3)实验中若用10 mL 12 mol/L的浓盐酸与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.015 mol,其原因是(假设各步反应无损耗,无副反应发生) 。
四、(本题包括2小题,共20分)
21.(10分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水反应可生成NH3,请填写下列空白:
(1)Na3N的电子式是 ,该化合物是由 键形成的。
(2)Na3N与水反应的方程式为: ,该反应属于
反应(从四种基本类型中选择)
(3)比较Na3N中两种粒子半径r(Na+) r(N3-)。(填“>”“<”或“=”)。
22.(10分)有A、B、C、D四种单质。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙,C和D化合生成化合物丁。已知甲、乙、丙的每个分子中分别都含有10个电子,并且甲、乙、丙、丁有如下图所示的关系。
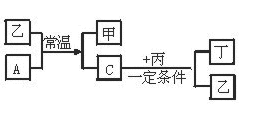
图1—3
请填写下列空白:
(1)单质B的化学式是 ,电子式是 。
(2)单质A和化合物乙发生反应的化学方程式为 。
单质C和化合物丙发生反应的化学方程式是 。
(3)试根据化合物丙、丁中D元素的化合价,判断丙和丁能否在一定条件下发生化学反应生成D的单质。若认为能反应,写出它们的化学方程式;若认为不能反应,简要说明理由。 , 。
![]() 五、(本题包括2小题,共18分)
五、(本题包括2小题,共18分)
23.(10分)已知:(1)烯键经臭氧氧化,再用Zn与水还原,可得到含 的化
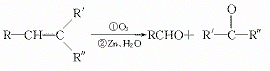
合物,如:
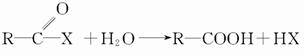
(2)酰卤极易与水反应,如:
某高分子化合物(C4H5Cl)n发生如下转化:
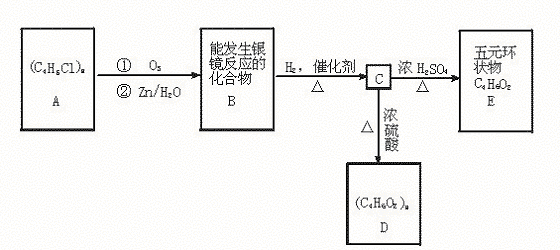
(1)写出A、E的结构简式:A: ,E: 。
(2)写出B转化为C的化学方程式 。
(3)写出C转化为D的化学方程式 。
24.(8分)烯烃A在一定条件下可按下面的框图进行反应:
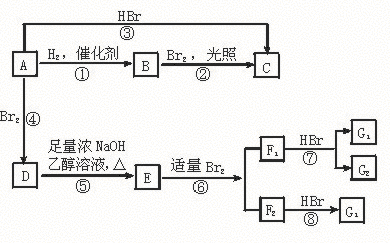
 请填空:(1)A的结构简式为
。
请填空:(1)A的结构简式为
。
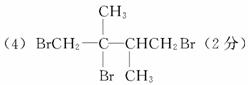
(2)框图中属于取代反应的是 。
(3)图中①、③、⑥属于 反应。
(4)G1的结构简式为: 。
六、(本题包括两小题,共16分)
25.(8分)在400 K、101 kPa时,2升烃A的蒸气在m升氧气中完全燃烧,反应后体积增至(m+4)升,(体积在相同条件下测定)。
(1)烃A在组成上应满足的条件是 。
(2)当m=15时,该烃的可能分子式为: 。
(3)若A在常温常压下为气态,则m的取值范围是 。
26.(8分)将固体FeC2O4·2H2O放在一个可以称量出质量的容器里加热,固体质量随温度变化的有关典型数据如下:
| 温度/℃ | 25 | 150 | 300 | 350 | 400 | 450 |
| 固体质量/g | 1.0000 | 0.9022 | 0.8000 | 0.8000 | 0.4000 | 0.4020 |
| 温度/℃ | 500 | 600 | 650 | 700 | 800 | 900 |
| 固体温度/g | 0.4444 | 0.4444 | 0.4390 | 0.4300 | 0.4296 | 0.4296 |
据上述数据计算分析:
(1)300℃~350℃时,质量不变的原因是 。
(2)350℃~400℃内发生反应的化学方程式是 。
(3)500℃时的固体物质是 。
(4)600℃~800℃内发生反应的化学方程式为 。
高考化学仿真试题(一)答案
一、1.B 2.B 3.B 4.D 5.B 6.B 7.A 8.A
二、9.BC 10.B 11.C 12.B 13.AC 14.BC 15.AD 16.C 17.A 18.B
三、19.(1)①③ ②⑤ (4分)
(2)①③④ A (4分)
(3)B (1分)
(4)B (1分)
20.(1)①:d a e (2分)
②:f a c (2分)
③:b c e (2分)
(2)F B E (3分)
(3)小于0.015 mol的原因是浓盐酸随着反应进行变成稀盐酸,从而反应停止 (3分)
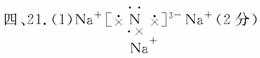
离子(2分)
(2)3Na3N+9H2O====9NaOH+3NH3↑ (2分)
复分解 (2分)
(3)< (2分)
22.(1)H2 H∶H (2分)
(2)2F2+2H2O====4HF+O2↑(2分)
4NH3+5O2 4NO+6H2O(2分)
(3)能(2分)
4NH3+6NO![]() 5N2+6H2O(2分)
5N2+6H2O(2分)
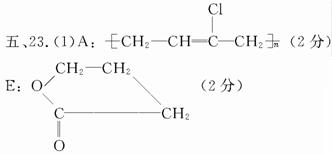
(2)HCO—CH2CH2COOH+H2 HOCH2CH2CH2COOH(3分)
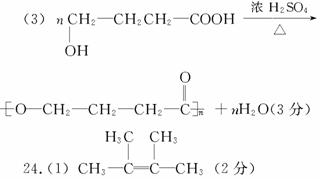
(2)②(2分)
(3)加成(2分)
六、25.(1)烃A分子中氢原子数等于8(2分)
(2)C2H8、C4H8、C5H8(3分)
(3)10≤m≤12(3分)
|
(2)FeC2O4====FeO+CO↑+CO2↑(2分)
(3)Fe2O3(2分)
(4)6Fe2O3![]() 4Fe3O4+O2↑(2分)
4Fe3O4+O2↑(2分)