高考化学题集锦(选择题部分)
(注:红色序号为答案)
1.关于生物体内的氨基酸的叙述错误的是 NH2 ( )
A.构成蛋白质的氨基酸分子的结构通式是R—CH—COOH
B.人体内氨基酸的分解代谢终产物是水、二氧化碳和尿素
C.人体内所有氨基酸均可以互相转化
D.两个氨基酸通过脱水缩合形成二肽
2.某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成份是 ( )
A.HCl和CO B.HCI、H2和CO C.CH4和NH3 D.HCl、CO和CO2
3.将20ml0.4mol·L-1硝酸铵溶液跟50mL0.1mol·L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是 ( )
A.[NO-3]>[OH-]>[NH4+]>[Ba2+] B.[NO-3]> [Ba2+]> [OH-]>[NH4+]
C.[Ba2+] > [NO-3]>[OH-]>[NH4+] D.[NO-3]> [Ba2+]>[NH4+]> [OH-]
![]() 4.某温度下,在一容积可变的容器中,反应2A(g)+B(g)
2C(g)达到平衡
4.某温度下,在一容积可变的容器中,反应2A(g)+B(g)
2C(g)达到平衡
时,A、B和C的物质的量分别为4mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是 ( )
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol
5.某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度。
下列叙述正确的是 ( )
A.沉淀物的质量为5.6g B.沉淀物的质量为7.4g
C.饱和石灰水的质量大于98.2g D.饱和石灰水的质量小于98.2g
6.在人体所需的十多种微量元素中,有一种称为“生命元素”的R元素,对延长人类寿命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物分子式为RO3,则R元素的名称为 ( )
A.硫 B.砷 C.硒 D.硅
7.“84”消毒夜在日常生活中被广泛使用。该消毒液无色,pH大于7,对某些有色物质有漂白作用。你认为它可能的有效成分是 ( )
A.SO2 B.Na2CO3 C.KMnO4 D.NaClO
8.油脂是油与脂肪的总称,它是多种高级脂肪酸的甘油酯。油脂既是重要食物,又是重要
的化工原料。油脂的以下性质和用途与其含有的不饱和双键( C=C )有关的是( )
A.适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素
B.利用油脂在碱性条件下的水解,可以生产甘油和肥皂
C.植物油通过氢化可以制造植物奶油(人造奶油)
D.脂肪是有机体组织里储存能量的重要物质
|
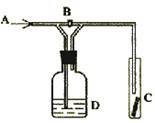
9.右图是一种试验某气体化学性质的实验装置,图中B
为开关,如先打开B,在A处通入干燥氯气,C中红
色布条颜色无变化;当关闭B时,C处红色布条颜色
褪去。则D瓶中盛有的溶液是 ( )
A.浓H2SO4 B.饱和NaCl溶液
C.浓NaOH溶液 D.浓NaBr溶液
10.咖喱是一种烹饪辅料,若白衬衣被咖喱汁玷污后,用普通肥皂洗涤该污渍时会发现,黄色污渍变为红色。经水漂流后红色又变为黄色。据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用 ( )
|
C.氯水 D.KI一淀粉溶液
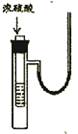
11.右图小试管中盛有几毫升水,与大试管连通的U型细玻管内放有少
量的水(已染成红色)。如沿小试管壁小心地慢慢注入3毫升浓硫酸,
静置片刻后,U型细玻管中可观察到的液面现象是 ( )
A.左高右低 B.左低右高
C.左右一样高 D.来回振动
其它:
12 . 微波”是一种高频电磁振荡,“微波炉”就是利用高频电振荡使食品中的分子也产生振荡现在医学上更使用“微波手术刀”进行外科手术,其好处主要是能使开刀的血液迅速凝固而减少失血,关于其作用原理的说法正确的是
A 微波电流迅速中和血液胶粒所带电荷而凝聚
B 微波使局部血液受热而使血液胶体凝聚
C 微波电流通过金属手术刀时产生的高温而使血液凝固
D 以上说法都正确
13. 传统饮用水的消毒剂是氯气。本世纪80年代初期科研人员在英国某城调查发现,儿童患白血病发病率高是源于饮了氯气消毒的饮用水,这是因为
A 氯气有氧化性,作用于正常细胞而癌化
B 氯水中的次氯酸具有杀菌性,氧化了正常细胞,异化为癌细胞
C 氯气有毒,杀死正常细胞,不杀灭癌细胞
D 氯气作用于水中有机物,生成有机氯化合物而致癌
14. 石墨和金刚石在一定条件下可相互转化:石墨![]() 金刚石-Q。20世纪50年代,美国通用汽车公司在实验室利用高温、高压(2000℃、20000atm)将石墨转化成金刚石之后,1989年,日本科学家用炸药和碳粉“炸出”金刚石的消息引起了人们的广泛关注。他们将炸药和碳粉混合并用石蜡固化后装入钢制敞口容器,沉入一个直径9m深约5m的混凝土水槽内,点火起爆,最后将容器里的水取出静置,可获得直径为0.002~0.003pm的超细金刚石粉。
金刚石-Q。20世纪50年代,美国通用汽车公司在实验室利用高温、高压(2000℃、20000atm)将石墨转化成金刚石之后,1989年,日本科学家用炸药和碳粉“炸出”金刚石的消息引起了人们的广泛关注。他们将炸药和碳粉混合并用石蜡固化后装入钢制敞口容器,沉入一个直径9m深约5m的混凝土水槽内,点火起爆,最后将容器里的水取出静置,可获得直径为0.002~0.003pm的超细金刚石粉。
1.从勒沙特列原理分析,上述两种制取金刚石的方法之所以都能获得成功的原因是
A 金刚石比石墨熔点低
B 金刚石的密度大于石墨
C 金刚石硬度很大
D 合成金刚石是吸热反应
2.炸药爆炸的瞬间,可以产生400000atm的超高压和5000t的超高温,完全能达到石墨转化成金刚石的条件,你认为将炸药放在水槽内的最主要原因是
A 形成高压条件
B 吸热降低温度
C 防止碳粉燃烧
D 溶解爆炸产生的气体
3.你认为工业上这种超细金刚石粉可以做
A 切削工具涂层 B 研磨剂 C 钻石戒指 D 制造石墨
15. 下列变化过程是物理变化的是:
A 在蛋白质溶液中,加入饱和硫酸铵溶液,有沉淀析出
B 皮肤不慎沾上浓硝酸而呈现黄色
C 向Fe(OH)3胶体中加入较浓的MgSO4溶液,呈浑浊状态
D 用稀释的福尔马林溶液(0.l%~0.5%)浸泡植物种子。
16. 2000年贝尔化学奖由美国的黑格、马克迪尔米德和日本的白川英树三人共享,他们发现有关导电聚合物,并研究出有机聚合导体的技术,这些材料可广泛应用于高亮度的液晶显示器等领域,对物理、化学的研究有重要意义。与该项成果相关的基础知识,不正确的有:
A 有机聚合物通常相对分子量很大,由共价键结合而成
B 在有机聚合物中掺入金属正离子即成为导电聚合物
C 导电聚合物比重小、强度大、可塑性好
D 导电聚合物、金属、电解质、半导体的导电微粒不同
17.石墨炸弹的破坏性主要是由于
A 石墨的可燃性
B 石墨的可导电性
C 石墨炸弹爆炸后形成粉尘,污染空气
D 石墨的熔点高,质软、片层间易滑动
18.贫铀炸弹的主要成份是铀238。![]() U要放出射线衰变成铅(
U要放出射线衰变成铅(![]() Pb)要经过的α衰变和β衰变的次数分别是
Pb)要经过的α衰变和β衰变的次数分别是
A 8,6 B 6,8 C 4,10 D 8,10
19.泽维尔用四氟二碘化碳做了下面的实验:
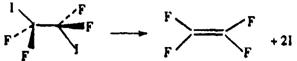
(“…”合承伸向纸内,“![]() ”表示伸向纸外)
”表示伸向纸外)
发现两个完全符同的C-I键是一先一后断裂的。以下有关上述反应类型的判断中正确的是
A 取代反应 B 加成反应 C 消去反应 D 加聚反应
泽维尔证实了光可诱发下列过程:
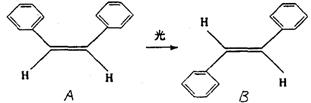
这一事实可用于解释人眼的夜视功能和叶绿素在光合作用中极高的光能利用率。以下叙述中正确的是
A 上述变化是化学变化
B A、B是同一种物质
C A、B的分子式是C14H14
D A、B都能发生加聚反应
20. 人类对赖以生存的地球环境保护问题越来越重视,如何减少或取代高污染的化学品的使用,一直是许多化学家奋斗的目标,生产和应用绿色化工原料是达到该目标的最有效手段,碳酸二甲酯(简称DMC)是一种新化工原料,1992年在欧洲被登为“非毒性化学品”,被誉为有机合成的“新基石”。下列关于DMC的说法正确的是
A DMC结构简式为 ![]()
B DMC在空气中能燃烧,产物为CO2和H2O
C DMC易溶于水,不溶于乙醇和丙酮
D DMC用于生产非毒性化工产品,故被誉为有机合成的“绿色化工原料”
21. 电解NaCl—KCl—AlCl3熔体制铝比电解Al2O3—NaAlF6制铝节省电能约30%,但现在仍用后一种方法制铝,其主要原因是
A AlCl3是分子晶体,其熔体不导电
B 电解AlCl3生成的Cl2会严重污染大气
C 自然界不存在富含AlCl3的矿石
D 生产无水AlCl3较困难,成本又较高
22. 近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和不锈钢为电极,以KI溶液(加少量K2CrO4)为电解液在一定条件下电解,反应方程式为KI+3H2O![]() KIO3+3H2↑。下列有关说法正确的是
KIO3+3H2↑。下列有关说法正确的是
A 电解时,石墨作阴极,不锈钢作阳极
B 电解液调节至酸性比较合适
C 电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D 电解中每转移0.6mol电子,理论上可得到21.4g无水KIO3晶体
22.实验室里所见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄,当玻璃管内装有碘时,用此仪器进行碘的升华实验,具有装置简单,现象明显,可反复使用的优点。用此仪器不能反复进行的实验是( )
A.NH4Cl受热分解的实验 B.KMnO4受热分解的实验
C.白磷和红磷在一定条件下相互转化的实验 D. 无水CuSO4与胆矾的互变实验
22.实验室用溴和苯反应制取粗溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏②水洗③用干燥剂干燥④用10%NaOH溶液洗⑤水洗正确的操作是( )
A.①②③④⑤ B.②④⑤③①
C.④②③①⑤ .②④①⑤③