高考化学专题训练
———实验设计
1. 图1-1装置是某种气体X的发生装置和收集装置(必要时可加热)。所用的试剂从下列试剂中选取2~3种,硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水。
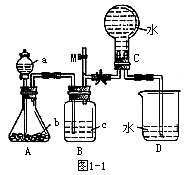
请回答下列问题。
(1)气体X的化学式是______。
(2)所选药品a中是_____,b是_____,装置B的作用是_______。
(3)用所选的药品制X时离子方程式是______。
(4)在反应刚开始时A中的主要现象是______。
(5)开关M的作用_____。
2.四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃;金属锡的熔点为231℃,拟用以下仪器,设计组装一套实验装置,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)请回答下列各个问题。
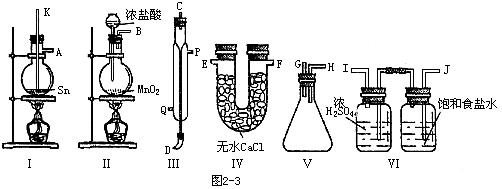
A.用玻璃管(未画出)连接上述装置,正确的顺序是(填各接口的代字母)
( )接( )、( )接( )、( )接( )、( )接( )、( )接( );
B.装置Ⅵ作用是______;装置Ⅳ的作用是______;
C.冷凝管里冷水的流向是从______进入,从________流出;
D.实验时应先点燃_______处酒精灯,加热温度应大于______℃,待_______即可停止加热;
E.已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为_______。
F.如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是________。
G.为了防止污染空气,在装置的最后应_______。
3.实验室里有一瓶KCl与CaCl2的固体混合物,通过下面实验可确定该混合物中KCl和CaCl2的质量比,也可制得纯净的KCl,根据实验步骤填写下列空白:
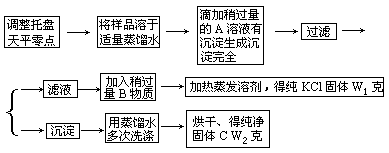
(1)调整零点时,若指针偏向左边,应将左边的螺丝帽向(填左、右)______旋动。
(2)某学生用已知质量y克的表面皿,准确称取W克样品,他在托盘天平的右盘放入(W+y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边,如图3-2示。
下面的操作应该是_______和______。
(3)加入的A是______,检验A是否过量的方法是______。
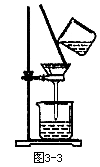
(4)过滤时,某学生的操作如图3-3所示,用文字说明图中的错误_____。
(5)滤液中加入的B物质是_______,应该加入过量B物质,理由是_____。
(6)为检验沉淀是否洗净,应在最后几滴洗出液中加入______,若______,表示沉淀已洗净。
(7)得到的固体C是_______。
(8)该混合物中KCl和CaCl2质量比的计算式是_____。
(9)配制100mL0.20mol·L-1的KCl溶液:某学生将准确称取的1.49gKCl固体放入烧杯中,加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,将溶液由烧杯转移到100mL容量瓶中,然后往容量瓶中小心地加蒸馏水,直到液面接近标线2—3cm处,改用胶头滴管加蒸馏水,使溶液凹面最低点恰好与刻度相切,把容量瓶盖盖好,振荡摇匀,该学生操作中错误的是_____。
4.实验室用如图4-3装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两只耐高温的瓷皿,其中共盛有56g细铁粉。实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,最后将d中液溴滴入100~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色磷片状溴化亚铁80g。请回答:
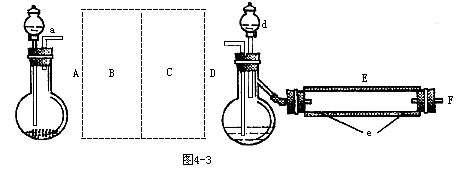
(1)如何检查用塞子(塞有导管和仪器)塞紧的D的气密性?
答:__________________________________________________
(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为:_______。若在A中盛固体CaCO3,a中盛有6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为______,C为_____。
(3)实验时,装置D和E的橡皮塞最好用石棉箔包住,原因是______。
(4)反应过程中要不断通入CO2,其主要作用是:①_____,②______。
(5)E中的反应为:
![]()
求此实验中溴化亚铁的产率:________。
(6)为防止污染空气,实验时应在F处连接盛______的尾气吸收装置。
5.实验室中可以用下列一些装置连接起来制纯净的CO2气体,并测定其分子量(用含少量FeS的大理石和盐酸制备CO2气体)。
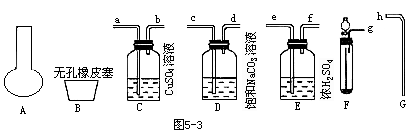
实验步骤如下:
(1)将橡皮塞B塞在A烧瓶上,并用皮筋套在烧瓶的瓶劲处以标记橡皮塞入瓶颈的深度,准确称量其质量为w1。
(2)连接制取和净化气体的装置,其连接顺序是:_____接______,______接_____,_____接_____,______接______。
(3)将导管G插入烧瓶A中用向_____(上/下)排气法收集CO2并检验CO2是否已经充满,检验CO2已充满的方法是______,用橡皮塞塞好烧瓶瓶口称其质量为w2。
(4)将烧瓶口瓶塞取下向烧瓶注水至标记线,再将水倒入量筒测量水的体积为VmL。
(5)记录当时实验时室温为t℃和压强为p帕。(R取8.314Pa·L·K-1·mol-1)
回答下列问题:
①计算CO2分子量的算式是________。
②若不将气体净化,所测定的CO2分子量的数值将_____(偏高/偏低),其原因是_____。
6.喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800名附近居民在一夜之间神秘死去,后经科学家考察发现,湖底有火山口,聚积了大量CO2和SO2等有毒气体。目前科技人员已找到一种有效的办法将湖底的有毒气体抽出并加以处理。
为了测定湖底取出的水样中SO2的含量,要在一定量的水样中加入一定量的碘(过量),再用已知浓度的硫代硫酸钠溶液滴定过量的碘,该反应为:
2Na2S2O3+I2=2NaI+Na2S4O6
(1)碘和水中SO2反应的化学方程式为_______。
(2)用硫代硫酸钠滴定过量的碘时,应选用______作指示剂,当溶液_____(填现象)便达到滴定的终点。
(3)若在20mL水样中加入碘Wg,用去VmLCmol·L-1的Na2S2O3溶液,则水样中的SO2的浓度为______mol·L-1。
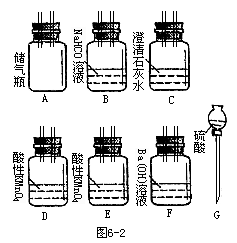
为了测定从湖底抽出的有毒气体中CO2的含量,需将CO2变成沉淀,然后测其质量,通过计算求出CO2的含量,从图中选择必要的装置(导管和胶管省略),设计实验,将CO2转变成沉淀。
(4)其所选装置的连接顺序是(从上到下从左至右的顺序)_______。
(5)将气体两次通过酸性高锰酸钾溶液的目的是_______。
(6)是否需要选择装置B,为什么?______。
(7)为了得到沉淀的质量还需要进行的操作有_______;还需要的仪器有________。
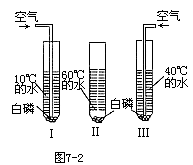
7.(1)白磷在O2中燃烧的现象是______。如果用白磷来进行如图7-2所示实验,Ⅰ、Ⅱ、Ⅲ发生的不同现象是______。由此你得出的结论是:______。
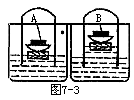
(2)如图7-3所示,玻璃罩中充满空气,在木块上的蒸发皿中,放入一块蜡状固体A,经过一段时间后发现水面上升了约1/5的高度。试分析:固体A是什么物质?水面A上升的原因是______。
(3)在白炽灯中常加入极少量的白磷,再充入定量的氮气,其作用是______
8.为了测定人体新陈代谢呼出气体CO2的体积分数,某学生课外小组设计了如图8-5的实验装置。实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶Ⅰ中溶液吸收CO2后的增重及剩余气体的体积。(实验时只用嘴吸气和呼气),请填空。
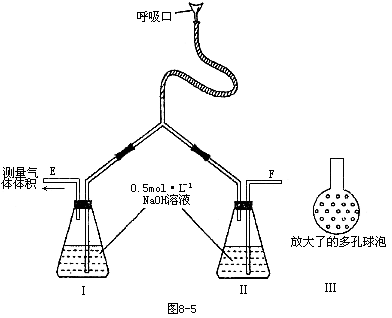
(1)图中瓶Ⅱ的作用是______。
(2)对实验装置尚有如下A、B、C、D四种建议,你认为合理的是(填代号)______。 [ ]
A.在E处增加CaCl2干燥管
B.在F处增加CaCl2干燥管
C.在E和F两处增加CaCl2干燥管
D.不必增加干燥管
(3)将插入溶液的管子下端改成具有多孔的球泡(图中的Ⅲ),有利于提高实验的准确度,其理由是_____________。
(4)实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶Ⅰ溶液增重ag,收集到的气体体积(标准状况)为bL,该呼出气体中CO2的体积分数是(列出算式):______________。
(5)实验中若猛吸猛呼,会造成不安全后果,猛吸时会_________,猛呼时会______________。
9.磷化氢(PH3)是无色剧毒气体(沸点-89.7℃,其中含微量P2H4而易自燃。其制取原理类似于实验室制氨气,现用图9-1装置制取PH3并验证其性质。请回答:
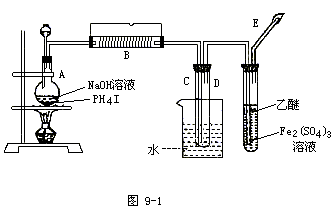
(1)用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式______。
(2)实验开始时,先从分液漏斗中往盛有碘化磷的烧瓶A中加入过量乙醚(无色液体,沸点34.5℃,微溶于水,不与Fe2(SO4)3反应),微热数分钟后再从分液漏斗中向烧瓶里加入一定量的浓NaOH溶液继续加热。在B处用电热器控制温度在300℃左右,实验过程中可观察到:
①用水冷却的C中有白色蜡状固体生成。
②D试管中Fe2(SO4)3溶液的颜色由棕黄色变成淡绿色,同时也有白色蜡状物生成。
③E处点燃尾气,呈淡蓝色火焰。则:
C中的白色蜡状固体是(填分子式)______,能说明PH3具有______性质。试管D中反应的化学方程式是______,说明PH3具有______性。
(3)实验时E处尾气须点燃,原因是______。
(4)实验开始时,先向烧瓶中加入乙醚并微热,其目的是______。
(5)D中液面上有少量乙醚层,出现的原因是______
10.今要以六水合氯化镁(MgCl2·6H2O)为原料制备无水氯化镁。已知:MgCl2·6H2O晶体在空气中加热时,会释放出部分结晶水,同时生成Mg(OH)Cl或MgO,在干燥的HCl气流中加热制得无水MgCl2。可选用的药品为:MgCl2·6H2O晶体,NaCl(固),KClO3(固),MnO2,浓H2SO4,浓盐酸,NaOH溶液。仪器装置见图10-2:
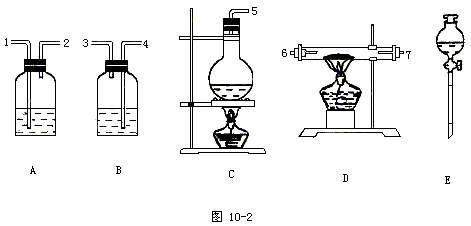
(1)组装HCl气体发生器时,应选用的装置是(填写编号)______,反应方程式是______。
(2)若气体流向是从左向右,则上述仪器接口的连接顺序(填写数字):______。
(3)各装置中应放的药品是:A_____B______C______D______E_______。
(4)B装置的作用是_______________。
1.(1)NO
(2)稀HNO3、铜屑、蒸馏水,洗去NO2
(3)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(4)铜屑溶解,溶液为浅蓝色,有气泡产生,瓶内上方出现棕红色气体
(5)收集X前,打开M,排出装置内空气
2.A.(B)接(J)、(I)接(K)、(A)接(C)、(D)接(G)、(H)接(E)或(F)
B.除去Cl2中的HCl和水气防止空气中水蒸气进入收集SnCl2的瓶内
C.Q.P
D.I,231,锡粒熔化
E.SnCl4+2H2O====SnO2+4HCl↑
F.有白色烟雾产生
G.用盛有NaOH溶液的烧杯吸收多余Cl2
3.(1)右(2)继续慢慢加入样品至天平指针指在标尺中间,称样完毕(3)K2CO3溶液,取上层清液少许,滴加盐酸,若有气泡产生,说明K2CO3过量 (4)一是玻璃棒未靠在滤纸上;二是漏斗底末端未靠在烧杯内壁上 (5)盐酸可使未反应的K2CO3完全转化为KCl (6)AgNO3溶液,无沉淀

4.(1)封闭一端,关闭分液漏斗的活塞,另一端用导管伸入水中,加热,有气泡放出。
(2)3Fe+4H2O![]() Fe3O4+4H2 B饱和NaHCO3溶液,C浓H2SO4
Fe3O4+4H2 B饱和NaHCO3溶液,C浓H2SO4
(3)Br2氧化腐蚀橡胶
(4)排D、E中的空气,使Br形成气流进入E中
(5)80%
(6)NaOH溶液
5.(2)g、c、d、a、b、e、f、h
(3)上;燃着的木条放在烧瓶口上方,火焰熄灭说明CO2已充满
![]()
②偏低:CO2气体中杂质气体H2S、HCl、H2O(g)比CO2分子量小
解析:(1)w1应为烧瓶,橡皮塞以及瓶内空气的质量。
(2)用装置F制取CO2气体,并分别经过装置D、C、E以除去HCl,H2S以及水蒸气等杂质,最后在烧瓶A中收集。
(3)CO2比空气重,故用向上排气法收集。检验CO2的方法通常是使燃着的木条熄灭的方法;w2为CO2气体、橡皮塞、烧瓶的总质量。
(4)V为收集的CO2的体积。
6.(1)SO2+I2+2H2O====H2SO4+2HI
(2)淀粉溶液,蓝色刚好褪去时
![]()
(4)G A D E F (D、E)可互换
(5)充分除去毒气中的SO2
(6)不需要,因为气体通过NaHCO3溶液,SO2与NaHCO3反应生成CO2,改变了原气体中CO2的量
(7)过滤、洗涤、干燥、称量;铁架台(带铁圈)、过滤器、玻璃棒、烧杯、干燥器、天平
7.(1)白烟,Ⅰ、Ⅱ不燃烧,Ⅲ中燃烧,可燃物燃烧的条件:温度达到着火点,与O2接触。(2)白磷,A吸收了空气中的某成分使罩内压强减小,故罩内水面上升,水上升的高度约为1/5,恰好是空气中O2的体积,所以A应为与O2在常温下反应且产生不为气体物质的物质,即白磷。(3)白磷除去灯泡内空气,防止灯丝被氧化,再充入氮气以保持内外压强平衡。
8.(1)除去吸入空气中的CO2(2)D(3)可增大气体与溶液的接触面积,使气体中的CO2被充分吸收
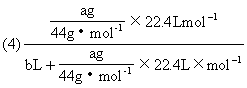
(5)把瓶Ⅰ中的NaOH溶液吸入口中:把瓶Ⅱ中的NaOH溶液吹出瓶外。
9.(1)PH4I+NaOH![]() PH3↑+NaI+H2O (2)P4受热分解,4PH3+6Fe2(SO4)3====P4+12FeSO4+6H2SO4,还原(3)尾气中含剧毒气体PH3,点燃尾气,以防环境污染(4)使密度大的乙醚蒸气把空气排净,以防止PH3因含P2H4在装置中自燃 (5)D中温度低于乙醚沸点乙醚蒸气在此会液化浮于液面。
PH3↑+NaI+H2O (2)P4受热分解,4PH3+6Fe2(SO4)3====P4+12FeSO4+6H2SO4,还原(3)尾气中含剧毒气体PH3,点燃尾气,以防环境污染(4)使密度大的乙醚蒸气把空气排净,以防止PH3因含P2H4在装置中自燃 (5)D中温度低于乙醚沸点乙醚蒸气在此会液化浮于液面。
10.(1)C,E;2NaCl+H2SO4(浓) ![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
(2)5,1,2,6,7,4,3
(3)浓H2SO4,NaOH溶液,NaCl固体,MgCl2·6H2O;浓H2SO4
(4)吸收HCl气体,防止污染空气