高三年级化学第二学期综合测试一
本试卷可能用到的相对原子质量:
H=1 O=16 C=12 Cl=35.5 N=14 S=32 Al=27 Ag=108 Na=23 Fe=56
第Ⅰ卷(选择题 74分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.工矿企业必须严格执行关于“三废”排放标准,并且尽可能地把“三废”变成有用的副产品,否则将会严重地污染环境。下列有关工业生产中的“三废”因任意排放,可能导致“光化学污染”的是
A.硫酸工业废气 B.工业生产硝酸的尾气
C.工业电镀锌的废水 D.火力发电厂的废渣
2.2001年1月,某地发生了导致四人死亡、一百多人中毒的食用熟牛肉中毒事件,经过对该牛肉的检测,发现某盐的含量比国家允许标准高800多倍,该盐可能是
A.NaCl B.NaNO2 C.NaNO3 D.BaSO4
3.生石灰中往往含有CaCO3和SiO2杂质,若检验是否存在这两种杂质,最适宜的试剂是
A.氟化氢 B.浓硫酸 C.盐酸 D.苛性钠
4.据报到,科学家于一九九六年在宇宙中发现H3分子,H2和H3属于
A.同素异形体 B.同位素 C.同系物 D.同分异构体
5.氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时,所克服的微粒间的作用力与氮化硼熔化所克服的微粒间的作用力相同的是
A.金刚石和硝酸钠 B.水晶和晶体硅 C.苯酚和萘 D.冰和干冰
6.下列各组物质的主要成分,皆为同一种酸所对应的盐的是
A.硫铁矿、赤铁矿、铝土矿 B.萤石、冰晶石、重晶石
C.苏打、大苏打、小苏打 D.生石膏、绿矾、芒硝
7.在标况下,一个装满Cl2的容器质量为74.6克,若装满N2则重为66克,那么此容器的容积为
A.22.4升 B.44.8升 C.11.2升 D.4.48升
8.下列有关物质的用途叙述不正确的是
A.AgI和干冰可用于人工降雨 B.皓矾和水玻璃可用做木材防腐剂
C.甲苯和甘油可用于制造炸药 D.医疗上常用无水乙醇作消毒剂
9.羟氨(NH2OH)是一种还原剂,将25.00ml 0.049mol/l的羟氨酸性溶液与足量硫酸铁在煮沸条件下反应,生成的Fe2+又恰好被24.50ml 0.02mol/l的酸性KMnO4溶液所氧化,在上述反应中,羟氨的氧化产物为
A.N2 B.N2O C.NO D.NO2
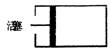 10.如图,标准状况下,向带有活塞的最大容积为120L的密闭容器中充入a mol
H2S和b mol SO2(a、b为正整数;a≤5,b≤5),则反应完全后,容器内气体可能达到的最大密度(g/L)是
10.如图,标准状况下,向带有活塞的最大容积为120L的密闭容器中充入a mol
H2S和b mol SO2(a、b为正整数;a≤5,b≤5),则反应完全后,容器内气体可能达到的最大密度(g/L)是
A.14.40 B.8.00 C.5.60 D.2.86
二、选择题(本题包括11小题,每小题4分,共40分。每小题有1—2个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该题为0分)
11.50mL浓度为1 mol/L的醋酸与100mL NaOH溶液混合后,所得溶液的pH=7(常温下),对该溶液的有关叙述,不正确的是
![]() A.[Na+] [CH3COO-] B.[CH3COO-]>[OH-]
A.[Na+] [CH3COO-] B.[CH3COO-]>[OH-]
C.原NaOH溶液的浓度为0.5mol/L D.原NaOH溶液的浓度大于0.5mol/L
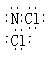
12.NCl3的电子式为 ,则NCl3和H2O反应时,最初的生成物一定有
A.NH3 B.HNO2 C.HClO D.NH4Cl
13.下列离子方程式正确的是
A.在氢氧化钡溶液中加入过量的小苏打
![]() Ba2++OH-+HCO
Ba2++OH-+HCO![]() BaCO3↓+H2O
BaCO3↓+H2O
B.在硫酸氢钠溶液中加入氢氧化钡溶液到pH=7
![]() Ba2++2OH-+2H++SO
Ba2++2OH-+2H++SO![]() BaSO4↓+2H2O
BaSO4↓+2H2O
C.将5.6克铁粉加入80毫升0.5摩/升的硝酸溶液中
![]() 3Fe+8H++2NO
3Fe+8H++2NO![]() 3Fe3++2NO↑+4H2O
3Fe3++2NO↑+4H2O
D.在碘化亚铁溶液中滴入少量氯水
![]() 2Fe+4I-+3Cl2 2Fe3++6Cl-+2I2
2Fe+4I-+3Cl2 2Fe3++6Cl-+2I2
14.可变的密闭容器中盛有适量的N2、H2混和气体,在一定条件下反应:N2+3H2
![]() 2NH3达到平衡时容器容积为V升,混合气体中NH3占体积20%,若压强、温度保持不变,下列推论不正确的是
2NH3达到平衡时容器容积为V升,混合气体中NH3占体积20%,若压强、温度保持不变,下列推论不正确的是
A.原N2、H2混合气体为100V升 B.参加反应的N2为0.1V升
C.原N2、H2混合气体为1.2V升 D.原混合气体中N2、H2体积比为1∶3
15.两个原硅酸分子的OH原子团之间可以相互作用而脱去一分子水:2H4SiO4
![]() OH
OH
![]() H6Si2O7+H2O,原硅酸结构为HO—Si—OH则在所得的H6Si2O7分子的结构中,含
H6Si2O7+H2O,原硅酸结构为HO—Si—OH则在所得的H6Si2O7分子的结构中,含
OH
有的硅氧键数目为
A.5 B.6 C.7 D.8
16.无机化学命名委员会(国际组织)在1989年作出决定,把长式周期表原先的主、副族号取消,由左至右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列,按这个规定下列说法正确的是
A.第3列元素种类最多,第14列元素的化合物种类最多
B.从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低
C.第10列元素中没有非金属元素
D.只有第2列元素的原子最外层有2个电子
17.某苯的同系物的分子式为C11H16,经测定,分子中除苯环外不再含其它环状结
![]()
![]() 构,分子中还有两个—CH3、两个—CH2—和一个—CH,则该分子中由碳链异构所
构,分子中还有两个—CH3、两个—CH2—和一个—CH,则该分子中由碳链异构所
形成的同分异构体共有
A.3种 B.4种 C.5种 D.6种
18.甲、乙两烧瓶中各盛有100mL 3mol·L-1的盐酸和氢氧化钾溶液,向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为
A.2.7g B.3.6g C.4.05g D.5.04g
19.用1kg溶剂中所含溶质的物质的量表示的溶液的浓度叫质量物质的量浓度,其单位是mol/kg。某物质的溶液的质量分数为1.96%,质量物质的量浓度为0.2mol/kg,则该物质可断为
A.NaHCO3 B.CaCO3 C.KHCO3 D.Na2CO3
20.分析有机物的结构应具有的性质是:
①缩聚反应 ②加成反应 ③取代反应 ④水解反应 ⑤中和反应 ⑥显色反应 ⑦氧化反应 ⑧还原反应 ⑨消去反应
A.只③⑤⑥⑦ B.只④⑤⑥⑦
C.全部 D.除①④外其余都有
21.酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,下列说法正确的是
![]() A.HB-水解方程式:HB-+H2O H3O++B2-
A.HB-水解方程式:HB-+H2O H3O++B2-
B.溶液中离子浓度大小为:[Na+]>[HB-]>[OH-]>[H+]
C.NaHB的存在抑制了水的电离
D.相同物质的量浓度溶液的pH值:Na2B>NaHB
第Ⅱ卷(非选择题 共76分)
三、填空题(本题包括3小题,共26分)
22.(8分)由A、B两气体组成的混合气体8.6克,在标准状况下占有体积为8.96升,已知A和B的物质的量之比为3∶1,摩尔质量之比为14∶1,则A可能为______
_______ ________ B为_________。
23.(8分)以A、B两根石墨棒作电极,电解硝酸银溶液,通电10分钟时,在B极收集到气体11.2毫升(标况)然后将电源反接,以相同的电流强度再通电5分钟,此时与第一次通电前相比较,两极的质量变化分别是A极__________ B极________(填增大、减少、不变) 其数值分别是A_________ B__________ 若溶液的体积为200毫升(设体积不变)则溶液的pH值为___________。
|
①A+NaOH—→D+H2O ②B—→A+H2O ③C+NaOH(适量)—→B+NaCl
④E+H2O—→NaOH+F ⑤C+D+H2O—→B,则A、B、C、D化学式分别是:
A_____________ B_____________ C______________ D_____________
写出4摩C与6摩E在水溶液中发生反应的化学方程式:_______________________
四、(本题包括两小题,共31分)
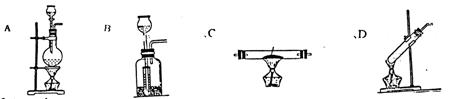 |
25.(16分)A—D是中学化学实验中常见的实验发生装置示意图
(1)请从1—8中选出适当的编号填入A—D的括号中
①亚硫酸钠和浓硫酸反应制取SO2
②过氧化钠和水反应制氧气
③苯和溴反应制溴苯
④无水醋酸钠和碱石灰混和制甲烷
⑤食盐和浓硫酸反应制氯化氢
⑥锌和盐酸反应制H2
⑦铜和氯气反应制无水CuCl2
⑧乙醇和乙酸、浓硫酸混和制乙酸乙酯
A( ) B( ) C( ) D( )
(2)选用装置B做乙炔的发生装置,B中小试管的作用是:__________________。说明能否除去小试管_________________。
26.(15分)某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO![]() 、S2-、CO
、S2-、CO![]() 、SO
、SO![]() 、SO
、SO![]() ,现取该溶液进行有关实验,实验结果如下图所示:
,现取该溶液进行有关实验,实验结果如下图所示:
![]()
![]()
![]()
![]()
![]()
![]() 气体甲
气体乙
气体丙
气体甲
气体乙
气体丙
| |||
| |||
|
![]()
![]()
![]() 无色溶液
溶液甲
溶液乙
溶渡丙
无色溶液
溶液甲
溶液乙
溶渡丙
![]()
![]()
![]() 浅黄色沉淀甲
白色沉淀乙
白色沉淀丙
浅黄色沉淀甲
白色沉淀乙
白色沉淀丙
试回答下列问题:
(1)沉淀甲是____________,(2)沉淀乙是__________,由溶液甲生成沉淀乙的离子方程式为:_________________________________。(3)沉淀丙是__________。
(4)气体甲成分可能有哪几种?(可以不填满也可以补充,多填要扣分)
| 1 | 2 | 3 | 4 | 5 | 6 |
(5)综合上述信息,可以肯定存在的离子:____________________________________
五、计算题(本题包括两小题,共19分)
27.(11分)一种含结晶水的羧酸A,在适当条件下完全分解为CO2、CO和H2O,取样6.3克,使其完全分解生成CO2 2.2克、CO 1.4克、H2O 2.7克,若中和0.2520克A需耗去20毫升0.2摩/升 NaOH溶液,若使0.005摩A完全转化为酯,则需要0.46克乙醇,通过计算求:
(1)A的最简式
(2)A的分子式
(3)A的结构简式
28.(8分)将固体FeC2O4·2H2O放在一个可以称出质量的容器里加热,固体质量随温度变化的有关典型数据如下表:
| 温度(℃) | 25 | 150 | 300 | 350 | 400 | 450 | 500 | 600 | 650 | 700 | 800 | 900 |
| 固体质量(g) | 1.0000 | 0.9022 | 0.8000 | 0.8000 | 0.4000 | 0.4020 | 0.4444 | 0.4444 | 0.4390 | 0.4300 | 0.4296 | 0.4296 |
据上述数据计算分析
a)300-350℃时质量不变的原因是什么?
b)350-400℃内发生反应的方程式__________________________
c)500℃时固体物质是什么?
d)600-800℃内发生反应的反应式__________________________
高三年级第二学期综合测试—化学答卷
一、
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | B | C | A | B | D | D | D | B | D |
二、
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 答案 | CD | AC | B | AD | D | AC | B | C | C | C | BD |
三、
22.A CO 、 N2 、 C2H4 ; B H2 。
23.A 增大 、B 增大 、A 0.108g 、B 0.108g 、pH= 2 。
24.A Al2O3 、 B Al(OH)3 、C AlCl3 、D NaAlO2 ,
![]()
四、
25.(1)A( 5 ) B(1、2、6) C( 7 ) D( 8 )
(2)液针,防C2H2从漏斗逸出,防漏斗被堵塞、不能。否则C2H2会逸出,或无法加水
26.(1)甲 S (2)乙![]() 、
、![]()
(3)丙![]() ,可能BaSO4
,可能BaSO4
(4)
| H2S | SO2 | CO2 | H2S、CO2 | SO2、CO2 |
|
五、
27.(1)CH3O3 (2)C2H6O6 (3)COOH
28.a ![]() 在300-3500C时又分解
在300-3500C时又分解
b ![]()
c Fe2O3
d ![]()