高三年级化学第一学期阶段考试
高 三 年 级
考试时间:120分钟 满分:150分
可能用到的原子量: H 1 O 16 S 32 C 12 Mg 24 Zn 65 Fe 56
第一卷 选择题(共72分)
一.选择题 (本题包括8小题 每小题4分 共32分。每小题只有一个选项符合题意)
1.将淀粉-KI混合溶液装在半透膜中,浸泡在盛有蒸馏水的烧杯中,取杯中液体进行实验,能证明半透膜有破损的是
A 加碘水变蓝色 B 加碘水不变蓝色 C 加氯水变蓝色
D. 加硝酸银溶液产生黄色沉淀
2.工业上生产硫酸时,吸收SO3气体使用的试剂是:
A 水 B 30%硫酸 C 98.3%硫酸 D 纯硫酸
3.下列说法正确的是
A. 放热反应在常温下一定很容易发生
B.需要加热才能发生的反应一定是吸热反应
C.人们利用化学反应只是为了制取所需要的物质
D.反应是放热还是吸热,主要取决于反应物和生成物所具有的总能量的相对大小
4. 下列盐溶液加入氯化钡溶液生成白色沉淀,再加入足量稀硝酸振荡后,白色沉淀完全消失的是 A.Na2SO3 B AgNO3 C Na3PO4 D Na2SiO3
5.NO2溶于水制硝酸的反应为:3NO2(g)+H2O (l) 2HNO3(l)+NO(g)(正反应为放热反应),为了提高硝酸的产率,硝酸厂实际采用的措施是
A.加压 B.升温 C.通入过量的O2 D.降温
6.50 g镁、锌、铁的混合物与足量的稀硫酸反应得到混合溶液,蒸发后得到218g固体(已换算成无水硫酸盐)。则反应产生氢气的质量是
A.2 g B.3 g C.3.5 g D.4.5 g
7. 某工厂排放的废硫酸,拟选用下列物质与之中和:
物 质 相对分子质量 市场参考价(元/kg)
CaCO3 100 1.8
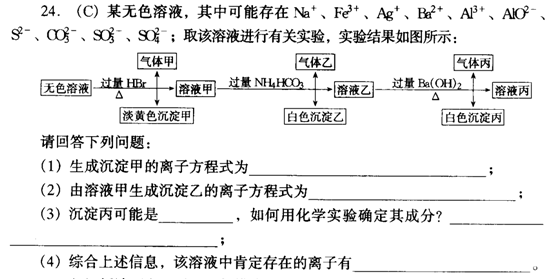
Ca(OH)2 74 2.0
NH3 17 6.5
NaOH 40 11.5
如果要求花最少的钱来中和同样量的废硫酸,则应选择
A.CaCO3 B.Ca(OH)2 C.NH3 D.NaOH
8.某可逆反应2A(g)+ 3B(g)![]() xC(g)+ 4D(g),若按下列两种配比:
xC(g)+ 4D(g),若按下列两种配比:
① 0.8molA,1.2molB,1.2molC,2.4molD
② 1.4molA,2.1molB,0.6molC,1.2molD
将它们放入一容积不变的密闭容器中,保持温度不变,达平衡后,C的质量分数仍然相等,则化学方程式中的x值为
A.2 B.3 C.4 D.1
二.选择题 (共10小题 每小题4分 共40分。每小题有一个或两个选项符合题意)
9.向氢氧化钙的悬浊液中加入少量生石灰后,若温度保持不变,下列判断正确的是
A.溶液中Ca2+数减少 B 溶液中Ca2+数不变 C 溶液pH不变 D溶液pH变大
10. 4.将pH=9的NaOH与pH=11的NaOH溶液等体积混合后,溶液的c(H+)为( )mol/L
A 1/2(10-9+10-11) B 1/2(10-5+10-3)
C 2×10-11 D 1/2 ×10-3
11.下列操作会引起实验误差的是
A.进行中和滴定时,直接向刚洗净的锥形瓶中加待测液
B.滴定未知浓度盐酸所用的0.05mol/LNaOH溶液, 在配制标准液时选用的NaOH因与空气接触而含有少量Na2CO3
C.用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂
D.往洗净的滴定管中,直接加入标准液.
12. 已知A、B、C、D、E五种物质,它们是硫或硫的不同价态化合物,已知在一定条件下有如下未配平的转化关系(注:每个关系式中化合价升降都各只有一处):①A+KOH→B+C+H2O ②C+E→B+H2O ③B+D→C+H2O ④C+Cl2+H2O→D+HCl,则这些物质中硫元素的化合价由低到高的次序是
A.A<B<C<D<E B.D<C<A<B<E
C.E<B<A<C<D D.B<A<C<E<D
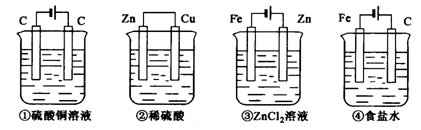
13. 如下图,四种装置中所盛的溶液体积均为 200mL,浓度为0.6mol/L,工作一段时间后,测得导线上均通过了0.1mol电子,此时溶液中的pH由大到小的顺序是
A.④②①③ B.④③①② C④③②① D.①③②④
14.将2molPCl3和1molCl2充入一容积不变的密闭容器中,在一定条件下反应:
PCl3(g)+ Cl2 (g)![]()
![]() PCl5(g),达到平衡时PCl5 为0.4mol。此时移走1molPCl3和0.5molCl2,在相同温度下达平衡时PCl5 的物质的量是
PCl5(g),达到平衡时PCl5 为0.4mol。此时移走1molPCl3和0.5molCl2,在相同温度下达平衡时PCl5 的物质的量是
A.0.4mol B 0.2mol C小于0.2mol
D.大于0.2mol而小于0.4mol
15.下列气体即不能用浓硫酸干燥,也不能用碱石灰干燥的是
A.NH3 B.SO3 C.HCl D.HBr
16. 已知金属元素X的金属性Y的强,则下列说法正确的是
A. X肯定能从Y的盐溶液中置换出Y
B. X离子的氧化性一定比Y离子的弱
C. X单质的还原性比Y的强
D. 1molX单质失电子数一定比1molY失去的多
17.某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子浓度关系正确的是
A. [Cl-]>[NH4+]>[H+]>[OH-] B. [NH4+]>[Cl-]>[OH-]>[H+]
C. [Cl-]>[NH4+]>[OH-]>[H+] D. [NH4+]+[H+]=[OH-]+[Cl-]
18. 在下列情况下, 离子组间一定能在溶液中同时大量共存的是:
A. 由水电离出的 [H+] = 10-14 mol/L 的溶液中: Na+、HCO3-、Cl-、SO42-
B. PH试纸呈现红色的溶液: Fe2+、K+、NO3-、Na+
C. CO32-可以大量共存的溶液: Ag+、K+、NO3-、Al3+
D. PH = 2 的溶液中: SO42-、K+、NO3-、Al3+
第二卷 非选择题(共78分)
三、实验题(本题包括2小题 共21分)
19.(6分).简答下面有关标准氢氧化钠溶液滴定待测盐酸的问题:
(1)盛放待测盐酸的锥形瓶下方垫一张白纸的作用是 。
(2)有下列错误操作:①碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准氢氧化钠溶液;②用酸式滴定管取用待测酸液前,尖嘴部分有气泡,取用过程中气泡消失;③滴定前,读碱液体积时视线低于碱式滴定管中的液面,滴定后读出碱液体积时,视线高于碱式滴定管中的液面;④锥形瓶用待测酸液润洗两次。
哪些错误操作会使盐酸浓度的测定值偏低?答: 。(填序号)
哪些错误操作会使盐酸浓度的测定值偏高?答: 。(填序号)
20.(3分)物质的量浓度相等的下列各物质的溶液中,NH4+. 浓度由大到小的顺序是
①(NH4)2CO3 ②(NH4)2SO4 ③ NH4HSO4
④(NH4)2 FeSO4 ⑤NH4Cl ⑥NH4HCO3
21.(12分) 要同时测定混有少量氯化钠杂质的芒硝(Na2SO4·nH2O)的纯度和结晶水的含量,按下列流程进行实验:
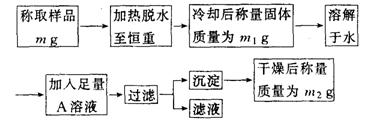
(1)加热脱水时,若有固体飞溅出来造成损失,则会使测得的结晶水的含量偏 。加热脱水后,若将样品露置于空气中冷却,则会使测得的结晶水的含量偏 。(填“高”或“低”)
(2)现有硝酸银、氯化钡、氯化钙、硝酸钡、氢氧化钡五种溶液,从测定的准确性考虑,可作为A溶液的分别是 。判断A溶液是否足量的方法是 。
(3)过滤时,应把滤纸上的沉淀洗涤干净,洗涤沉淀的方法是 。
(4)通过实验,测得芒硝化学式中的n值为10,则芒硝的纯度为 %
四、填空题(本题包括2小题 共18 分)
22 (10分)在一定温度下,把2.0体积N2和6.0体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,如下图。容器中发生的反应如下:
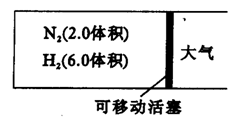
N2+3H2 ![]()
![]() 2NH3+Q(Q>0)
2NH3+Q(Q>0)
若反应达到平衡后,测得混合气体为7.0体积。试回答:
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2、NH3的体积,如果反应达到平衡后,混合气体中各物质的体积分数仍与上述平衡完全相同。那么:
①若 a =1.0,c = 2.0,则 b = 。在此情况下,反应起始时将向 方向进行(填“正”或“逆”)。
②若规定起始时反应向逆方向进行,则c的范围是 。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是 。
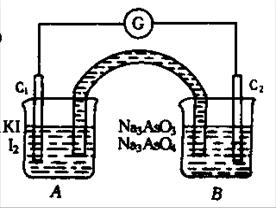
23.(8分)已知反应AsO43-+2I-+2H+ ![]()
![]() AsO33-+I2+H2O是可逆反应。现设计如图所示的实验装置,进行下述操作:①向B烧杯中逐滴加入浓盐酸,发现微安表指针偏转;②若改向B烧杯中滴加40%的NaOH溶液,发现微安表指针向前述相反方向偏转。试回答下列问题:(1) 两次操作过程中指针为什么会发生偏转?
AsO33-+I2+H2O是可逆反应。现设计如图所示的实验装置,进行下述操作:①向B烧杯中逐滴加入浓盐酸,发现微安表指针偏转;②若改向B烧杯中滴加40%的NaOH溶液,发现微安表指针向前述相反方向偏转。试回答下列问题:(1) 两次操作过程中指针为什么会发生偏转?
(2) 两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释之。
(3) ①操作过程中C1棒上发生的反应为 。
(4) ②操作过程中C2棒上发生的反应为 。

五、推断题(本题包括2小题 共18 分)
25.(8分)下列各物质转化关系如图所示,A是一种高熔点固体,D是一种红棕色固体。根据上述一系列转化关系回答:
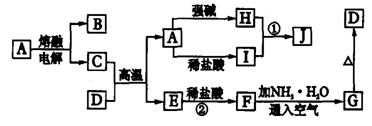

(1)填写物质的化学式:A ,D 。
(2)写出下列反应的离子方程式:
①H溶液和I溶液混合生成J 。
②F生成G 。
六.计算题 (本题包括2小题 共21分)
26.(9分)用溴酸钾测定苯酚纯度的步骤如下:称取含苯酚0.6000g的试样溶于20.00ml 0.1250mol/L的KBrO3溶液(该溶液含有过量的KBr),加酸酸化,放置;待反应完全后加入KI溶液,然后用0.1050mol/LNa2S2O3溶液滴定生成的碘,滴定终点为20.00mol。计算试样中苯酚的质量分数。(已知: 6H+ + BrO3 - + 5Br- = 3 Br2 + 3H2O
I2 + 2Na2S2O3 = 2NaI + Na2S4O6 )
27.(12分)合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)11.2升(标准状况)CH4按上式完全反应,产生H2 mol。
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。11.2升(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为 。
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 12.5 | 5 |
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)。
(4)若CH4和H2O(g)及富氧空气混合反应的产物中,V(H2)/V(N2)=
3︰1 (合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为何值?(设富氧空气中O2的体积分数为a)
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | C | D | C | C | C | B | A | AC |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | BD | C | C | C | BD | C | BD | D |
19. (1)便于观察指示剂颜色的变化
(2)偏高 ①③④ 偏低②
20. ④②①③⑤⑥
21.(1)高 ; 低
(2)氯化钡、硝酸钡、氢氧化钡;低;向滤液中滴入A溶液,若有沉淀析出,则说明加入A溶液的量不足,反之,加入A溶液已足量。
(3)向漏斗中的沉淀上加水至锓没沉淀,待水滤出,重复操作数次即可。
(4)322m2/233m ×100
22.(1)①3.0,逆 ② c>2a/3 或 c>2b/9
(2)适当降低温度或加压
24 (3)碳酸钡或碳酸钡和硫酸钡的混合物;加入足量的稀硝酸,若沉淀全部溶解,只含碳酸钡;若沉淀部分溶解,为两者混合物。
(4)Na+ AlO2- S2- SO32-
25 (1)Al2O3 Fe2O3
26. 30.1%
27. (1)1.5mol
(2)22.4升<V<33.6升
(3)VO2/VN23=1
(4)X/Y=1-7/3a