高三年级化学试卷
第Ⅰ卷(选择题共52分)
可能用到的原子量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32
Cl:35.5 K:39 Ca:40 Fe:56
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意)
1.1998年诺贝尔化学奖授予科恩(美)和波普尔(英)以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命的变化。下列说法正确的是 ( )
A.化学不再是纯实验科学
B.化学不再需要实验
C.化学不做实验,就什么都不知道
D.未来化学的方向还是经验化
2.下列物质中,有固定沸点的是 ( )
A.碘酒 B.电石 C.液氨 D.重晶石
3.下列各化学式中,能表示物质的真实分子组成的是 ( )
A.Fe B.CsCl C.H2O2 D.SiO2
|
|
|
A.NaCl Na+ :Cl: B.HClO H :Cl:O:
|
|
|
|
C.-CH3 H:C : D.NH4I [H : N :H]+I-
5.下列变化,前者属于物理变化,后者属于化学变化的是 ( )
A.磺化、碳化 B.分馏、干馏
C.风化、裂化 D.渗析、盐析
二、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
6.随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中可装入的物质是 ( )
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
7.14C是碳的一种同位素,NA为阿伏加德罗常数,下列说法中不正确的是:①1/8mol14CH4分子中所含中子数为NA②7g14C原子形成的石墨中所含质子数为3NA③17g甲基(-14CH3)所含电子数为8NA④常温常压下,22.4L14CO2其分子数为NA
A.①② B.①③ C.①②③ D.③④
8.下列叙述正确的是 ( )
A.酸酐一定是氧化物
B.碱性氧化物一定是金属氧化物
C.非金属氧化物一定是酸性氧化物
D.金属氧化物一定是碱性氧化物
9.在一定条件下,KclO3与I2按下式发生反应:2KClO3+I2===2KIO3+Cl2,由此可推断下列相应的结论,不正确的是 ( )
A.该反应为置换反应 B.还原性:I2>Cl2
C.非金属性:I2>Cl2 D.氧化性:KclO3>I2
10.“纳米技术”广泛的应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是( )
A.能全部通过半透膜 B.能发生丁达尔现象
C.一定能导电 D.一定为悬浊液或乳浊液
11.下列各组离子中,在溶液中能够大量共存的一组是 ( )
A.AlO2-、SO42-、Cl-、K+ B.Al3+、Ca2+、HCO3-、Na+
C.Fe3+、NH4+、SO42-、SCN- D.H+、Cl-、Na+、HPO42-
12.下列离子方程式中正确的是 ( )
A.氨水中加入明矾溶液:3OH-+Al3+===Al(OH)3↓
B.硫酸铜溶液中加入氢氧化钡溶液:SO42-+Ba2+===BaSO4↓
C.碳酸氢铵溶液中加入足量的氢氧化钠溶液:
NH4++HCO3-+2OH-===NH3·H2O+CO32-+H2O
D.向漂白粉溶液中通入SO2气体:
Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
13.物质的量浓度相同的NaNO3、Mg(NO3)2、Al(NO3)3三种溶液,取三种溶液的体积比为3:2:1时,三种溶液中c(NO3-)之比为 ( )
A.1:1:1 B.1:2:3
C.3:2:1 D.3:4:3
14.对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+等微粒)。分别进行如下实验:①加热时放出的气体可使品红溶液褪色②加碱调pH至碱性后,加热时放出的气体可使润湿的红色石蕊试纸变蓝③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀NHO3。对于上述微粒不能确认其在原溶液中是否存在的是 ( )
A.Br- B.SO42- C.H2SO3 D.NH4+
15.下列实验方法:①用渗析法分离蛋白质和葡萄糖的混合液②用盐析法分离法油皂化反应的产物③用升华法分离I2和砂子的混合物④用重结晶法分离KNO3和NaCl的混合物⑤用分液法分离H2O和C2H5-Br的混合物⑥用蒸馏法分离C2H5OH与C6H5-OH(沸点为182℃)的混合物。你认为上述方法 ( )
A.只有①不正确 B.②⑤⑥不正确
C.只有③④⑥正确 D.全部正确
16.有三组物质:①NO2和Br2蒸气②C2H5CHO、C6H6、C6H5-NO2三种无色液体③CaC2、CuSO4(无水)、CaCO3、Na2SO4、干燥的碱石灰(含少量酚酞)五种固体,只用水就能区别开的是 ( )
A.① B.①② C.②③ D.①②③
17.几种酸碱指示剂变色的pH值范围如下:①甲基橙3.1~4.4②甲基红4.4~6.2③酚酞8.2~10。现用0.10mol/LNaOH溶液滴定浓度相近的HCOOH,则上述指示剂 ( )
A.都可以用 B.只能用③
C.可以用①或② D.可以用②或③
18.恒温下的下列实验过程中,有关溶液的浓度和质量始终不变的是 ( )
A.向浓氨水中持续通入干燥洁净的空气(不含CO2)
B.向KNO3饱和溶液中加入ngKNO3晶体
C.向98.3%浓H2SO4中加入ngSO3
D.向CuSO4饱和溶液中加入ng无水CuSO4
19.在一定条件下,RO3n-和F2可发生如下反应:RO3n-+F2+2OH-===RO4-+2F-+H2O,从而可知在RO3n-中,元素R的化合价是 ( )
A.+4 B.+5 C.+6 D.+7
20.痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这3种物质都正确的是 ( )
A.①AgNO3②NaBr③AgBr B.①AgNO3②NaCl③AgCl
C.①AgCl②AgNO3③NaCl D.①AgNO3②NaI③AgI
三、选择题(本题包括4小题,每小题3分,共12分。每小题只有一个选项符合题意)
21.已知在1.01×105Pa、298K条件下,2molH2燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A.H2O(g)==H2(g)+1/2O2(g);△H=+242kJ/mol
B.2H2(g)+O2(g)==2H2O(I);△H=-484kJ/mol
C.H2(g)+1/2O2(g)==H2O(g);△H=+242kJ/mol
D.2H2(g)+O2(g)==2H2O(g);△H=+484kJ/mol
22.某温度下,向盐A的饱和溶液(质量分数a%)中加入mg无水盐A,同温下析出ngA·xH2O晶体,则从饱和溶液中析出的溶质质量为(设A式量为M):
A.n×a% B.n-m C.![]() D.(n-m)×a%
D.(n-m)×a%
23.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
A.21:5 B.11:3 C.3:1 D.4:1
24.在2KNO3+S+3C===K2S+N2↑+3CO2↑的反应中,被2molKNO3氧化的C的质量是( )
A.15g B.18g C.21g D.30g
第II卷(非选择题共48分)
四、填空题:
25.(4分)(1)室温下,将2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,写出C6H6燃烧热的热化学方程式 。
若lg水蒸汽转化成液态水放热2.44kJ,则室温下C6H6完全燃烧生成1mol水蒸气时的燃烧热为 。
26.(4分)配平氧化还原反应方程式,标出电子转移的方向和数目。
(1) NH3+ NO2→ N2+ H2O
(2)氧化产物与还原产物的质量比为 。
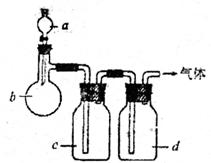
27.(8分)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去,必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
| 气体 | a | b | c | d |
| C2H4 | C2H5OH | 浓H2SO4 | NaOH溶液 | 碱石灰 |
| Cl2 | 浓HCl | KMnO4 | 饱和NaCl溶液 | 浓H2SO4 |
| H2S | 稀HNO3 | FeS | 饱和NaHS溶液 | 无水CaCl2 |
| NO2 | 浓HNO3 | Cu | H2O | P2O5 |
|
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体 ,理由是 。
②气体 ,理由是 。
③气体 ,理由是 。
④气体 ,理由是 。
28.(5分)用24.5的H2SO4溶液(ρ=1.20g/cm2)配制100mL0.20mol/LH2SO4溶液时,要用到的玻璃仪器有:容量瓶、酸式滴定管、烧杯、量筒、玻璃棒和 。使用容量瓶时应先检查其是否 ;用 量取 mL24.5%硫酸溶液进行配制。
29.(6分)下列操作一定会使实验结果偏高的是:
A.用标准HCl溶液滴定未知浓度的NaOH溶液,碱式滴定管未经润洗就直接取
20mLNaOH溶液
B.用冷却结晶法测定不同温度下的KNO3的溶解度,没有在析出晶体时立即读温度计的读数
C.用加热法测定CuSO4晶体中结晶水的含量,坩埚不干燥,且加热不充分
|
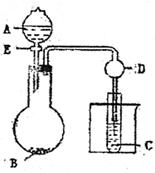
30.(11分)用下图所示装置进行实验,将A
逐滴加入B中:(1)若A为浓H2SO4,B
为第三周期金属元素的片状单质,其在常
温下难与水反应;C为品红溶液,实验中
观察到溶液褪色,则B是 (化
学式),B与浓H2SO4反应的方学方程式为
;反应后往烧杯中加入沸水,又可观察到试管C中的现象为 。
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是 。然后往烧杯中加入沸水,可观察到试管C中的现象是
。
(3)若B是生石灰、实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是 (名称),C是 与葡萄糖的混合液,仪器D在此实验中的作用是
。
五、计算题:
31.(10分)已知有关物质的氧化性强弱顺序为:浓H2SO4>Fe3+>H+。现将30.0gFe粉(过量)与50.0mL浓H2SO4在加热条件下充分反应,共收集到11.2L(STP)气体(设生成的气体全部逸出),其质量为19.6g。试计算:
(1)浓H2SO4的物质的量浓度
(2)反应后剩余铁粉的质量
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | A | C | C | C | B | B | D | B | C | B | A | C |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 答案 | B | B | D | D | B | B | B | B | A | D | D | D |
25.C6H6(1)+15/2O2(g)===3H2O(I)+6CO2(g);△H=-3260.4kJ/mol
△H=-3128.64kJ/mol。
失3e-×8
![]() ↓
↓
26.(1)8、6、7、12 8NH3+6NO2= 7N2+12H2O
![]() ↑
↑
得4e-×6
(2)4:3
27.(1)Cl2
(2)①C2H4;装置中没有温度计,无法控制反应温度
③H2S;稀硝酸有氧化性,可将H2S氧化;
④NO2;生成的NO2与水反应生成了NO,收集的是NO。
28.胶头滴管;漏水;酸式滴定管;6.67。
29.B、E
30.(1)Mg;Mg+2H2SO4===MgSO4+SO2↑+2H2O
C中溶液变红;
(2)酸性比碳酸的酸性强;溶液由浑浊变澄清;
(3)浓氨水(或铵盐的浓溶液);AgNO3; 防止倒吸。
31.6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+Fe=3FeSO4
得2H2SO4 + Fe = FeSO4 + SO2↑ +2H2O
2n1(H2SO4)n1(Fe) n1(SO2)
H2SO4 + Fe = FeSO4 + H2↑
n2(H2SO4) n2(Fe) n2(H2)
n1(SO2)+n2(H2)=11.2L ÷ 22.4mol/L =0.50mol
64g/mol×n1(SO2)mol+2g/mol×n2(H2)mol=19.6g
n1(SO2)=0.30mol,n2(H2)=0.20mol
(1)c(H2SO4)=(0.60mol+0.20mol)÷0.05L=16.0mol/L
(2)剩余m(Fe)=30.0g-56g/mol×(0.30mol+0.20mol)=2.0g.