高三年级化学试题2
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试时间120分钟
可能用到的原子量:H:1 O:16 C:12 S:32 Ca:40 Na:23 P:31
Cu:64 Br2:81
第Ⅰ卷(选择题,共74分)
一、选择题(本题包括8个小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.下列叙述中正确的是
A、分子晶体中可能不存在化学键;B、离子晶体中只存在非极性键;
C、原子晶体中只存在非极性键; D、金属的硬度均很大;

 2.下列表达式错误的是
2.下列表达式错误的是
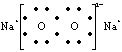
A、过氧化钠的电子式:
B、硫离子的结构示意图:
C、乙烯的结构简式:CH2CH2
D、溶液中电离方程式: HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
3.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是 ( )
| ① | ② | ③ | ④ | ⑤ | |
| 甲 | 物质微粒数 | 标准状况下气体摩尔体积 | 固体体积 | 溶液的质量百分比浓度 | 非标准状况下物质的质量 |
| 乙 | 阿伏加德罗常数 | 标准状况下气体体积 | 固体密度 | 溶液的体积 | 物质的摩尔质量 |
A.②③④ B.③④⑤ C.③④ D.③
4.大气污染物氟里昂—12的分子式是CF2Cl2,它是一种卤代烃,关于它的说法中正确的是( )
A.它有两种同分异构体 B.它是极性分子
C.它的空间构型为正四面体 D.它不属于有机物
5. 下列实验操作会引起测定结果一定偏高的是
A.测定硫酸铜晶体结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上自行冷却
B.用湿润的pH试纸测定溶液的PH
C.为了测定一包白色粉末的质量,将药品放右盘,砝码放左盘,并需移动游码使之平衡
D.装待测液的滴定管用水洗后,没用待测液润洗2-3次
6.砒霜的主要成分是As2O3,剧毒,致死量为0.1 g。As2O3是两性偏酸性氧化物,微溶于水,生成H3AsO3;该酸及其对应的盐也均有毒性,其中碱金属对应的盐溶于水,其他金属对应的盐均几乎不溶于水。下列关于处理一瓶含有砒霜废液的方案中正确的是
A.直接倒入下水道 B.经过滤后倒入下水道
C.加入足量生石灰,倒入指定地点 D.加入足量氢氧化钠后,倒入指定地点
7.下列说法正确的是 ( )
![]() A.在其它条件不变情况下给平衡体系:2NO2 N2O4加压,重新达到平衡后,混合
A.在其它条件不变情况下给平衡体系:2NO2 N2O4加压,重新达到平衡后,混合
气体的颜色比原平衡颜色深
B.室温下,Ph=7的(NH4)2SO4溶液中,C(NH4+)=C(SO42-)
C.加入浓硝酸,可加快Zn与稀盐酸反应制氢气的反应速率
D.0.1 mol·L-1醋酸溶液中加入少量醋酸钠晶体后,溶液的导电性减弱
8.在氯化钠晶体中,与每个Na+等距离且距离最近的几个Cl-所围成的空间几何构型为
A、十二面体;B、八面体;C、正六面体;D、正四面体;
二、选择题(本题包括10小题,每小题5分,共50分。每小题有一个或两个选项符合题意,若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分)
9.下列有关物质的性质的判断正确的是
A、水中的溶解性:C2H5Br>C2H5OH B、沸点:HF>HCl
C、熔点: 金刚石> C60 D、氧化性:O2>O3
10.在硫酸的工业制法中,下列生产操作与主要原因二者都正确的是
A、硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧
B、接触室中两层催化剂之间装上热交换器,加热炉气并冷却反应后生成的气体
C、SO2氧化为SO3时需要用催化剂,这样可以提高SO2的转化率
D、SO3用98%的浓H2SO4吸收,以防止形成酸雾,以便使SO3吸收完全
11.甲乙两杯醋酸稀溶液,甲的PH=a;乙的PH=a+1,下列判断正确的是
A、甲由水电离出来的H+浓度是乙的1/10倍;
B、物质的量浓度是V甲=10V乙;
C、中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,C甲>10C乙;
D、甲中的OH-离子浓度为乙中OH-离子浓度的10倍;
12.某无色溶液中,不能大量共存的离子组是
A、Ba2+、K+、I-、OH; B、Cu2+、K+、SO42-、NO3-;
C、Al3+、Mg2+、AlO2-、Cl-; D、Ca2+、Na+、HCO3-、NO3-;
13.下列离子方程式书写不正确的是
A、在氢氧化钡溶液中逐滴滴加硫酸氢钠溶液至恰好中和;
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B、在苯酚钠溶液中通入少量二氧化碳;
2C6H5O-+H2O+CO2→2
C6H5OH +CO32-
C、在澄清石灰水中滴加过量碳酸氢钙溶液;
Ca2++HCO3-+OH-=CaCO3↓+H2O
D、在含0.1mol溴化亚铁溶液中慢慢通入 0.1molCl2;
2Fe2++2Br-+2Cl2=2Fe3++Br2+4 Cl-
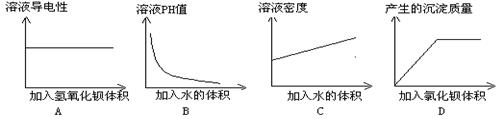
14.某同学在一定量的稀硫酸溶液中加入一定量的其他溶液,并测定有关的实验数值数值。实验后,将有关实验数据绘制成如下图象,其中正确的是
15.据已有知识和元素性质递变规律来判断下列比较不正确的是
A、第二周期氢化物易燃性:CH4>NH3>H2O;
B、第三周期氢化物稳定性:相SiH4>PH3>H2S>HCl;
C、化合物毒性:若PH3>NH3,则H2S>H2O;
D、最高价氧化物对应水化物的酸性: HClO4>HNO3>H3PO4>H4SiO4;
16.脑白金,其有效成分的结构简式为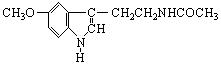 。下列对该化合物的叙述正确的是
。下列对该化合物的叙述正确的是
A.它属于芳香烃 B.它属于高分子化合物
C.分子式为C13N2H16O2 D.在一定条件下可以发生加成反应
17.设NA为阿佛加德罗常数,下列说法正确的是
A、在铁与硫的反应中,1mol铁失去的电子数为2 NA;
B、1molCH3+中含电子数为8 NA;
C、标准状况下22.4LSO3中含原子数为4 NA;
D、常温常压下11.2LCO2气体通过足量的Na2O2充分反应,转移电子数为2NA;
18.将胆矾与生石灰、水按质量比为1∶0.56∶100混合配成无机铜杀菌剂波尔多液,其成分的化学式可表示为CuSO4·XCaSO4·xCu(OH)2·yCa(OH)2,此种配比当x=3时,则y为
A、1;
B、3;
C、5; D、7;
第Ⅱ卷(非选择题,共76分)
三、(本题包括两个小题,共21分)
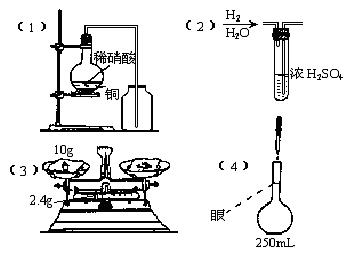
19.下列图中所示的实验方法、装置或操作有错误,指出错误所在,不必作图。
(1)制取NO
错在 。 后果是 。
(2)氢气的干燥
错在 。改正的方法是 。
(3)称量硝酸钾
错在 。 这种称法,所得硝酸钾的质量是 。
(4)将溶液稀释至250mL 错在 。
观察点如图所示,继续加水稀释到刻度线时,溶液的浓度偏 (大或小)。
20.实验室里用下图示出的装置制取溴化亚铁。其中,A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈管,e是两只耐高温的瓷夹,其中共盛有56g细铁粉。实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中的物质开始反应,不断地将d中的液溴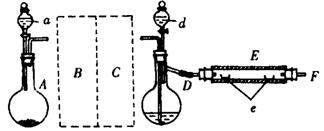 滴入100~120℃的D中,经过几小时的连续反应后在不锈钢管一端沉积有黄绿色鳞片状溴化亚铁80g。
滴入100~120℃的D中,经过几小时的连续反应后在不锈钢管一端沉积有黄绿色鳞片状溴化亚铁80g。
(1)如何检查D装置的气密性?
(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为 。
(3)在A中盛有CaCO3,a中盛有6mol·L-1盐酸。为使A中产生的CO2在进入D之前既干燥又纯净,B、C处应设置和各仪器中应盛有何种试剂?
。
(4)实验时,D和E的橡胶塞为什么最好用铝箔包住?
(5)反应过程中要不断地通入CO2,其主要作用是:① ② 。
(6)为防止污染空气,实验时应在F处连接盛有 的尾气吸收装置。
四、(本题包括2小题。共18分)
21.(8分)已知A~K所代表的各物质都是中学化学里常见的物质,且I是具有磁性的物质,D和K都具有两性。一定条件下,各物质间的相互反应转化关系如下图所示:
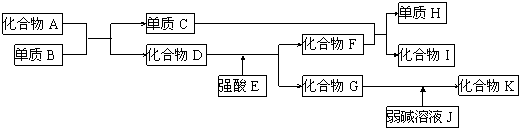
请回答:⑴写出有关物质的化学式:D是_____,H是________。
⑵写出下列反应的化学方程式:
① 化合物G的溶液不呈中性,其原因用离子方程式表示为______________
② C+F→H+I________________________________。
22.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
① c(Cl-) > c(NH4+) > c(H+) > c(OH-) ② c(Cl-) > c(NH4+) > c(OH-) > c(H+)
③ c(NH4+) > c(Cl-) > c(OH-) > c(H+) ④ c(Cl-) > c(H+) > c(NH4+) > c(OH-)
填写下列空白。
(1)若溶液中只溶解了一种溶质,则该溶质是______________,上述四种离子浓度的大小顺序为________________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为______________________________;
若上述关系中④是正确的,则溶液中的溶质为__________________________________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系c(H+)____________c(OH-)。
五、(本题包括2小题,共17分)
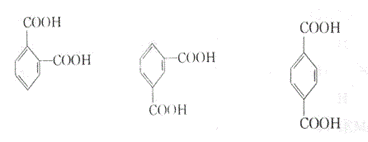
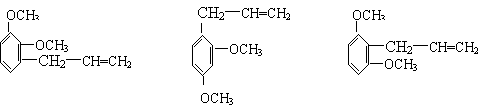
23.(9分)下列三种有机物都是某些植物挥发油中的主要成分。
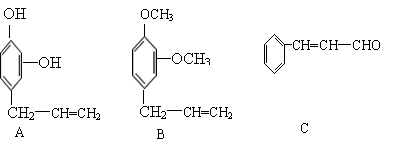 |
回答下列问题
⑴这三种有机物均属于(选填字母)______
a 芳香烃 b 酚类 c 芳香族化合物 d 醛类
⑵A能发生的反应类型(选填字母)_____
a、消去 b、与氢氧化钠溶液中和 c、加成反应 d、氧化反应
e、加聚反应 f、还原反应
⑶一定质量的有机物C,在足量的O2中完全燃烧,生成CO2和消耗O2的物质的量之比为_____
⑷B分子有多种同分异构体,其中均含有两个“—OCH3”和一个“—CH2—CH=CH2”基
团的芳香族化合物有五种,请写出其余两种的结构简式:______________、
______________________
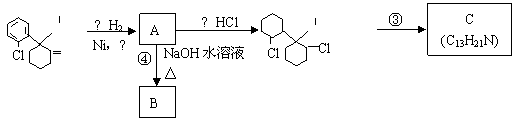
24.“摇头丸”中含有氯胺酮成分。氯胺酮在一定条件下发生下列一系列转化:
 CH3 CH3
CH3 CH3
NH NH·HCl
O
(1)写出氯胺酮的分子式______________________;
(2)上述转化过程中发生取代反应的是____________;
反应③的条件是_____________________。
(3)C的结构简式可能为_________________、___________________。
六、(本小题包括2小题,共20分)
25.超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:![]()
![]() 。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)取10.00 g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36 L(标准状况)。
①上述反应的化学方程式为_______________________________________;
②该样品中AlN的质量分数为_________________。
(2)另取10.00 g样品置于反应器中,通入2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34 g/L(已折算成标准状况,AlN不与O2反应)。该样品中含杂质炭_______g。
26.A为烃,B为烃的含氧衍生物,由等物质的量的A和B组成的混合物0.05mol在0.125molO2中恰好完全燃烧生成0.1molCO2和0.1mol H2O ,通过计算回答:
(1)从分子组成的角度分析,该混合物的组合可能有几种?
(2)另取一定量的A和B的混合物完全燃烧,将其以任意比混合且物质的量和一定。
①若耗氧一定,则A和B的分子式分别是 、 。
②若生成CO2和H2O的物质的量一定,则A和B的分子式分别是 、 。
参考答案:
1、A 2、C 3、C 4、B 5、C 6、C 7、A 8、B
B
9、BC 10、BD 11、A 12、BC 13、B 14、D 15、B
16、CD 17、AB 18、D
19.(1)未用排水法收集,得不到纯净的NO(或NO要被氧化成NO2)。
(2)进气管与出气管位置装反,互换进出气管位置。
(3)砝码和称量物位置放错,10-2.4 = 7.6(g)。
(4)视线没有与容量瓶的刻度线保持水平,小。
20.(1)封闭一端,关闭分液漏斗的活塞,另一端用导管伸入水中,加热,有气泡放出。
(2)3Fe+4H2O![]() Fe3O4+4H2 B饱和NaHCO3溶液,C浓H2SO4
Fe3O4+4H2 B饱和NaHCO3溶液,C浓H2SO4
(3)Br2氧化腐蚀橡胶
(4)排D、E中的空气,使Br2形成气流进入E中
(5) NaOH溶液
21.(8分)
⑴ D是Al2O3(2¹) H是H2(2¹)
⑵①Al3++3H2O ![]() Al(OH)3-+3H+ (不用
Al(OH)3-+3H+ (不用![]() 不给分。不配平或不注明反应条件或条件注明错误的只给1分,下同) (2¹)
不给分。不配平或不注明反应条件或条件注明错误的只给1分,下同) (2¹)
⑶3Fe+4H2O=Fe3O4+4H2↑(2¹)
22.(1)NH4Cl ①
(2)NH4Cl和NH3 NH4Cl 和HCl
(3)小于 大于
 23.(9分)
23.(9分)
⑴C(1¹)⑵cdef(2¹)⑶6∶7(2¹)
⑷
24.(1)C13H16NOCl(1分)
(2)②、④(2分);强碱的醇溶液加热(1分)
![]()
![]()
![]() CH3
CH3
CH3
CH3
![]()
![]()
![]() NH
NH
NH
NH
![]()
![]() (3)
(1分);
(1分)
(3)
(1分);
(1分)
25.(1)AlN+NaOH+H2O→NaAlO2+NH3↑
(2)61.5%
(3)1.92
26.(1)平均分子式为C2H4O
CH4和C3H4O2 C2H4和C2H4O2 C2H2和C2H6O2 C2H6和C2H2O2 C3H6和CH2O2
(2)①C2H2和C2H6O2 ②C2H4和C2H4O2
备用题(10分)取3.320 g只含羧基,不含其他官能团的固态芳香族羧酸[其表示式
为:(H2O)x(CO2)yCz]置于4.00 L氧气中,经点燃后羧酸完全燃烧,反应后气体体积
变化(增加或减少)0.224 L,将气体通过足量的固体过氧化钠后,体积减少1.792 L(所
有气体均为标准状况下测定)。请回答:
(1)3.320 g该羧酸中碳原子物质的量为 ;
(2)该羧酸中C、H、O的原子数之比为 ;
(3)写出符合以上各条件的相对分子质量最小的芳香族羧酸的结构简式 。
(10分)
(1)0.160 mol (2)4∶3∶2
⑶