高三年级月考化学试卷
可能用到的相对原子质量:C:12 O:16 N:14 H:1 Cu:64 S:32
第一卷(满分45分)
一、 选择题(每小题只有一个正确答案,每小题3分,共45分)
1.某微粒用![]() R
R![]() 表示,下列关于该微粒的叙述正确的是
表示,下列关于该微粒的叙述正确的是
A、所含质子数=A―n B、所含的中子数=A―Z
C、所含的电子数=Z+n D、质量数=Z+A
2.下列关于铜电极的叙述中正确的是
A、铜锌原电池中铜作正极 B、用电解法精炼粗铜时粗铜作阴极
C、在镀件上电镀铜时可用金属铜作阴极 D、电解稀硫酸制氢气和氧气时铜作阳极
3.反应E+F=G在温度T1进行,反应M+N=K在温度T2下进行,已知T1>T2,且E和F的物质的量浓度均大于M和N的浓度(其它条件均相同),则两者的反应速率
A、前者大 B、后者大 C、一样大 D、无法判断
4、已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合,下列说法正确的是
A、C3N4晶体是分子晶体
B、C3N4晶体中,C—N键的键长比金刚石中的C—C键的键长要短
C、C3N4晶体中每个碳原子连接3个氮原子,而每个氮原子连接4个碳原子
D、C3N4晶体熔沸点较低
5、在装有饱和Na2CO3溶液的烧杯中,插入惰性电极进行电解,若电解过程中始终保持温度不变,则通电一段时间后
A、溶液中的pH将增大 B、溶液中的H2O分子数与CO32-离子数的比值将变小
C、溶液中Na+数目将减少 D、还原产物与氧化产物的质量之比为8:1
6、设NA为阿佛加德罗常数,下列叙述正确的是
(1)常温常压下,22.4L氖气含有NA个氖原子 ;(2)1mol过氧化钠固体跟足量的二氧化碳气体完全反应,转移2NA个电子 ;(3)1molCH3+含有8NA个电子 ;(4)1mol氧气在反应中得到的电子数一定是4NA ;(5)1molOH-在电解过程中被氧化,提供的电子数为4NA ;(6)0.1mol/L的Na2S溶液中含Na+的数目为0.2NA ;(7)31g白磷(P4)中含有3/2 NA个P—P键。
A、(3)(7) B、(2)(3)(7) C、(1)(3)(5) D、(2)(4)(5)(6)
7、下列叙述中正确的是
A、阳离子一定是金属离子,阴离子一定只含有非金属元素
B、某金属元素的阳离子和某非金属元素的阴离子组成的物质一定是纯净物
C、阴、阳离子相互作用后,不一定形成离子化合物
D、离子化合物都是强电解质,一定都溶于水
8.下列离子反应方程式正确的是( )
A、用Zn和醋酸反应来制取H2 Zn + 2H+ = Zn2+ + H2↑
B、实验室制取NH3 NH4++OH- = NH4OH
C、尾气H2S用CuSO4溶液吸收 H2S + Cu2+= CuS↓+2H+
D、向漂白粉溶液中滴入少量的Na2SO3溶液 Ca2+ +SO32- = CaSO3↓
![]() 9.对于平衡体系:mA(g)+nB(g) pC(g)+qD(g),下列判断正确的是
9.对于平衡体系:mA(g)+nB(g) pC(g)+qD(g),下列判断正确的是
A.若温度不变,将容器的容积增大1倍,达到新平衡时,A的浓度变为原来的0.45倍,
则![]()
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若升高平衡体系的温度平衡常数增大,说明该反应△H<0
D.若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原体积要小
10.若将1molH2S氧化成为S,则消耗下列氧化剂的物质的量最少的是
A、KMnO4 (H+) B、Cl2 C、O2 D、SO2
11. A、B、C、D、E五种短周期元素。A、B、C位于同一周期相邻位置,A和C的原子序数之比为3:4,A、B、C分别与D形成化合物分子中都含有10个电子。E的原子结构示意图中从内到外各层的电子数之比为1:4:1。则下列叙述中正确的是
A、A和C形成的某种化合物能与E的单质在一定条件下能发生置换反应
B、实验室制备B、D两种元素形成的化合物发生的反应属于氧化还原反应
C、由A、C原子和B、D原子分别构成的分子都是极性分子
D、由A、B、C、D四种元素组成的化合物中不可能含有离子键
12. 在某未知溶液中,溶入醋酸钠晶体后,测得c(Na+)和c(CH3COO-)之比接近1:1,则对原溶液判断正确的是
A、不可能是碱性溶液 B、可能是强酸性溶液
C、原溶液中一定不含有CH3COO-
D、原溶液中可能已有CH3COO-,且c(Na+):c(CH3COO-)<1
13.从20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通的氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它存在的证据,若该氧分子具有空间对称结构,你认为该氧分子是
A、氧元素的一种同位素 B、臭氧的同分异构体
C、一种新的氧化物 D、可能是非极性键构成的非极性分子
14.向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着
pH的升高,沉淀增多,但当![]() 时,沉淀消失,出现亮绿色的亚铬酸根CrO2-。
时,沉淀消失,出现亮绿色的亚铬酸根CrO2-。
![]()
![]() 其平衡关系如下:Cr3++3OH- Cr(OH)3 CrO2-+H++H2O
其平衡关系如下:Cr3++3OH- Cr(OH)3 CrO2-+H++H2O
(紫色) (灰绿色) (亮绿色)
向0.05mol/L的Cr2(SO4)3溶液50mL中加入1.0mol/L的NaOH溶液50mL,充分反应后,
溶液中可观察到的现象为
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
15.在常温下,有两种稀氨水,它们物质的量浓度、氢离子浓度、氢氧根离子浓度、pH分别为c1、c2,c(H+)1、c(H+)2,c(OH-)1、c(OH-)2,pH1、pH2。已知:pH1=pH2+1,则下面的关系正确的是
A、c1:c2=10:1 B、c(OH-)1:c(OH-)2 =2:1
C、c(H+)1:c(H+)2 =1:10 D、c1<c2
一、 选择题(每小题只有一个正确答案,每小题3分,共45分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
第二卷(满分55分)
二、填空题(满分45分)
![]()
 16.下图为一些常见仪器的部分结构:(7分)
16.下图为一些常见仪器的部分结构:(7分)
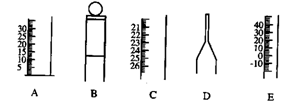 |
(1)请写出仪器名称:A B C D E
(2)检查B是否漏水的方法是
。
17.(8分)在某化学实验中,有如下循环过程,试回答下列问题:
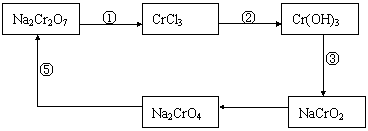 |
(1)在上述有编号的步骤中,需要还原剂的是 ,需要氧化剂的
是 (填编号)
(2)在上述循环中,既能与强酸反应又能与强碱反应的物质是 (填化学式)。
(3)请配平下列反应的化学方程式。
□Na2CrO7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□H2O
18. (12分)NH4Cl和C2H5Br都能与水发生水解反应,反应中H2O分子按两种方式离解:
a离解成氢离子(H+)和氢氧根离子(OH-)
b离解成氢原子(H)和羟基(-OH)
(1)NH4Cl水解的化学方程式 ,
水的离解方式 (填字母代号,下同);C2H5Br水解化学方程式
,水的离解方式 。
(2)Mg4C3的水解按“a”式进行,化学方程式 。
(3)PCl3的水解按“b” 式进行,化学方程式 。
19.(6分)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu==2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-==Cu2+;还原反应为:2Fe3++2e-==2Fe2+。
(1)请据此将反应3NO2+H2O==2H++2NO3-+NO拆写为两个半反应式。
氧化反应___________________________________________;
还原反应___________________________________________。
(2)已知某一反应的半反应式CH4+10OH- -8e-==CO32-+7H2O,O2+2H2O+4e-==4OH-。
则总方程式为 。
20.(13分)如图中每一方框中的字母代表一种反应物或生成物。已知A、B、C、D均为前三周期元素的单质,也是中学化学常见的物质。其中A、B为固体,且B是良好的半导体材料;C、D为气体。电解H的饱和溶液生成X、C和D,此反应是一个重要的化工反应。(物质间相互转化时水已略去)
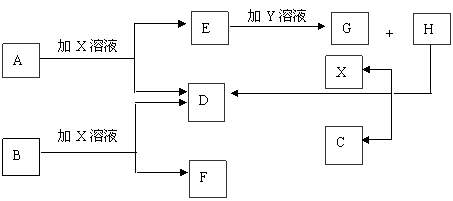 |
请填空:
(1)写出下列物质的化学式:
A C X 。
(2)B单质为 晶体(填晶体类型)
(3)E和G在水溶液中混合反应的离子方程式为 ;
(4)25℃时,用石墨电极电解含0.4molH物质的水溶液,在阳极产生0.1mol气体,测得此
时溶液体积为200mL,则此时该溶液的pH约为 。
 21.(9分)硫酸和盐酸混合溶液20
21.(9分)硫酸和盐酸混合溶液20![]() ,加入0.05
,加入0.05![]() 的
的![]() 溶液时,生成
溶液时,生成![]() 沉淀量及溶液pH发生如右图所示的变化
沉淀量及溶液pH发生如右图所示的变化
(1)开始时混合溶液中硫酸和盐酸
的物质之量浓度各是多少?
(2)在A点溶液的pH是多少?
1.B 2.A 3.D 4.B 5.C 6A。 7.C 8.C 9.B 10.A 11.A 12.D 13.D 14.C 15.C
16.(1)A量筒 B容量瓶 C滴定管 D胶头滴管 E温度计
(2)
17.(1)①;④ (2)Cr(OH)3 (3)1、6、14、2、2、6、3、7
18.(1)NH4Cl+H2O ![]() NH3·H2O+HCl、a、C2H5Br+H2O→C2H5OH+HBr、b (2) Mg4C3+H2O=4Mg(OH)2 +C3H8(3)PCl3+3H2O=H3PO3+HCl
NH3·H2O+HCl、a、C2H5Br+H2O→C2H5OH+HBr、b (2) Mg4C3+H2O=4Mg(OH)2 +C3H8(3)PCl3+3H2O=H3PO3+HCl
19.(1)2NO2—2e-+2H2O=4H++2NO3— 2NO2+2e-+2H+=NO+H2O
(2)CH4+2O2+2OH—=CO32—+3H2O
20.(1)Al、Cl2、NaOH(2)原子(3)3AlO2-+Al3++6H2O=4Al(OH)3(4)14
21.解答:c(H2SO4)==0.05mol·L-1
c(HCl)==0.2mol·L-1
⑵ c(H+)==0.1mol·L-1
pH=1