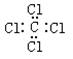高三上学期期中测试化学试卷
第Ⅰ卷(72分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 P-31 S-32
Cl-35.5 K-39 Ca-40 Fe-56 Cu-64 Ag-108 I-127 Ba-137
一、选择题(每小题只有1个选项符合题意。每小题4分,共32分。)
1.下列化合物中都属于弱电解质的一组是 ( )
A.CuSO4、NaCl、HNO3、K2SO4 B.H2CO3、CH3COOH、HclO、苯酚
C.K2S、BaSO4、AgCl、NaOH D.H2O、H3PO4、NH3·H2O、HBr
2.下列化学式既能表示物质的组成,又能表示物质分子式的是 ( )
A.NH4NO3 B.SiO2 C.C6H5NO2 D.Cu
3.下列晶体中含有非极性共价键的离子晶体是 ( )
①硅晶体 ②H2O2 ③CaC2 ④NH4Cl ⑤Na2O2 ⑥苯酚
A.①②④⑥ B.①③ C.②④⑤⑥ D.③⑤
4.有下列物质:①白磷 ②金刚石 ③石墨 ④二氧化硅 ⑤甲烷 ⑥四氯化碳 ⑦单晶
硅 ⑧铵离子,其分子结构或晶体结构单元中存在正四面体的是 ( )
A.除③外 B.只有①②⑤⑥ C.除③⑧外 D.除③④⑦⑧外
5.下列变化属于物理变化的是 ( )
A.O2在放电条件下变成O3
B.加热胆矾成无水硫酸铜
C.漂白的草帽久置于空气中变黄
D.氢氧化铁胶体加入MgSO4溶液产生沉淀
6.下列化合物中阳离子半径与阴离子半径比值最小的是 ( )
A.NaF B.MgI2 C.BaI2 D.KBr
7.在相同条件下,下列物质分别与H2反应,当消耗等物质的量的氢气时放出热量最多的是
( )
A.Cl2 B.I2 C.Br2 D.S
8.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数118,中子数为175的超
重元素,该元素原子核内中子数与核外电子数之差是 ( )
A.57 B.47 C.61 D.293
二、选择题(每小题可能有1—2个选项符合题意。每小题4分,共40分。)
|
|
A.氨 B.四氯化碳
|
|
C.氮气 D.二氧化碳
10.已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,②K2Cr2O7+6FeSO4+7H2SO4=
3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。下列结论正确
的是 ( )
A.①②③均是氧化还原反应
B.氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2
C.反应②中氧化剂与还原剂的物质的量之比为6∶1
D.反应③中0.1mol还原剂共失去电子数为6.02×1022
11.下列离子方程式中正确的是 ( )
A.碳酸氢钙与稀硝酸反应:HCO3-+H+=H2O+CO2↑
B.饱和石灰水与醋酸溶液混合:Ca(OH)2+2CH3COOH=Ca2++2CH3COO-+2H2O
C.氢氧化镁溶于稀硫酸:Mg(OH)2+2H+=Mg2++2H2O
D.向酸性FeSO4溶液中滴入H2O2:Fe2++H2O2+2H+=Fe3++2H2O
12.2gAO32-中核外电子数比质子数多0.05NA(NA代表阿伏加德罗常数)个,则元素A的相
对原子质量为 ( )
A.12 B.32 C.60 D.80
13.下列离子在溶液中因发生氧化还原反应而不能大量共存的是 ( )
A.H3O+、NO3-、Fe2+、Na+ B.Ag+、NO3-、K+、Cl-
C.K+、Ca2+、OH-、SO42- D.Cu2+、NH4+、Br-、NO3-
14.已知35%NaOH溶液的密度为1.38g·cm-3,5%NaOH溶液的密度为1.05g·cm-3,若将
上述两种溶液等体积混合,所得NaOH溶液的质量分数是 ( )
A.大于20% B.等于20% C.小于20% D.无法确定
15.设NA为阿伏加德罗常数,下列说法不正确的是 ( )
A.标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA
B.18g水中含有的电子数为10NA
C.在1L2mol/L的硝酸镁溶液中含有的NO3-离子数为4NA
D.常温下,27g金属铝与足量的稀硫酸反应,生成H2的体积约为33.6L
16.A和M为两种无素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法
中正确的是 ( )
A.A和M的原子序数之差为8
B.A和M原子的电子总数之和可能是11
C.A和M原子的最外层电子数之和为8
D.A和M原子的最外层电子数之差为5
17.某结晶水合物的化学式为R·nH2O,其式量为M,25℃时将ag该晶体溶于bg水中达到
饱和,并得到VmL溶液,下列表达式正确的是 ( )
A.饱和溶液的物质的量浓度为![]()
B.饱和溶液的溶质的质量分数为![]()
C.25℃时R的溶解度为![]()
D.饱和溶液的密度为![]()
18.在一定条件下,硫酸铵的分解反应为:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,
当有mmol电子转移时,下列说法不正确的是 ( )
A.有2nmol(NH4)2SO4分解 B.有![]() 原子被还原
原子被还原
C.生成![]() 氧化产物 D.生成7nmolH2O
氧化产物 D.生成7nmolH2O
第Ⅱ卷(78分)
三、填空题(30分)
19.(10分)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸
及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2(二氟化氙)
和KBrO3首先制得BrO4-,不久得到纯净KBrO4晶体。
(1)已知XeF2与水反应生成O2和氙气,氟则以化合态留在水溶液中,每生成1molO2,
转移电子数 mol。该反应的氧化剂是 。
(2)写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式是
。
(3)根据上面的信息,指出BrO4-的稳定性与pH的关系 。
20.(14分)阳离子Na+、Ag+、Mg2+、Cu2+和阴离子Cl-、NO3-、OH-、SO42-两两组成(不
重复)A、B、C、D四种可溶性化合物,它们起反应时的现象如下:
A+B→白↓, B+D→白↓,C+D→蓝↓
由此判断:A ,B ,C ,D 。(写化学式)
上述生成沉淀的离子方程式为:(1) ,
(2) ,
(3) 。
21.(6分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
。
若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+![]() O2(g)=H2O
O2(g)=H2O
(1)的△H= kJ·mol-1
四、实验题(15分)
22.实验室要用98%(ρ=1.8g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸 mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须
用到的实验仪器是(填写序号):
①500mL量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平
⑥胶头滴管 ⑦锥形瓶 ⑧玻璃杯 ⑨酸式滴定管
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所
配制的硫酸溶液浓度偏低的是 。
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶
内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
(4)若配制时,因加水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?
答:
五、推断题(14分)
23.A、B、C、D、E、F为原子序数依次增大且原子序数均大于10的主族元素。已知A、C、
F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能
反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子
次外层电子数比最外层电子数多3。回答:
(1)写出下列元素的符号:A 、D 、E ;
(2)写出B、F形成的化合物的电子式 ;
(3)A、C两种元素最高价氧化物的水化物反应的离子方程式为:
(4)D的固态氧化物是 晶体,含n mol D的氧化物的晶体中含D—O共价健
为 mol。
六、计算题(20分)
24.(8分)在室温下,向100mL Cu(IO3)2饱和溶液中加入足量的经酸化的KI溶液,发生如
下的反应:5I-+IO3-+6H+=3I2+3H2O 2Cu2++4I-=2CuI↓+I2反应完全后,用
0.10mol·L-1Na2S2O3溶液滴定,I2+2S2O32-=2I-+S4O62-,消耗了40 mLNa2S2O3溶液,
计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度。
(2)若Cu(IO3)2饱和溶液的密度为1.0g·cm-3,室温时Cu(IO3)2的溶解度是多少?
|
![]() Al2O3+N2+3C 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂
Al2O3+N2+3C 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂
质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液
反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为:
②该样品中的AlN的质量分数?
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后
测得气体的密度为1.34g·L-1(已折算成标准状况,AIN不跟O2反应)。该样品中
含杂质炭的质量为多少?
上学期高三期中测试
化学试卷参考答案
一、二、
1. B 2.C 3.D 4.A 5.D 6.B 7.A 8.A 9.BD 10.BD 11.AC 12.B 13.A 14.A 15.AD 16.BD 17.C 18.AD
三、
19.(1)4;XeF2(6分) (2)XeF2+2OH-+BrO3-=Xe+2F+BrO4-+H2O(3分)
(3)pH越大,BrO4-越稳定(1分)
20.AgNO3、MgCl2、CuSO4、NaOH (1)Ag++Cl-=AgCl↓(2)Mg2++2OH-=Mg(OH)2↓
(3)Cu2++2OH-=Cu(OH)2↓(每空2分,共14分)
21.H2(g)+![]() O2(g)=H2O(g); △H=-241.8kJ/mol(4分)。
-285.8(2分)
O2(g)=H2O(g); △H=-241.8kJ/mol(4分)。
-285.8(2分)
四、
22.(1)100mL(4分) (2)②④⑥⑧(5分) (3)ABCD(4分)
(4)将容量瓶中的溶液倒出并洗涤干净后,再重新配制。(2分)
|
|
23.(1)Na Si P (2) Mg2+ (3)OH-+Al(OH)3=AIO2-+2H2O
(4)原子;4n(每空2分,共14分)
六、
24.解:n(S2O32)=0.10mol·L-4×40mL×10-3L/mL=0.0040mol
从题中所给方程可得出关系式:2Cu(IO3)~13I2~26S2O32-
n[Cu(IO3)]=0.0040mol![]() (3分)
(3分)
C[Cu(IO3)]=![]() (1分)
(1分)
(2)解:n[Cu(IO3)]=0.0040mol![]()
100mL溶液的质量=100mL![]()
溶剂水的质量=100g-0.13g=99.87g (1分)
室温时Cu(IO3)2的溶解度![]() (2分)
(2分)
25.(1)①AIN+NaOH+H2O→NaAlO2+NH3↑ (3分)
②解:![]()
![]() ~NH3
~NH3 ![]() (2分)
(2分)
![]() (1分)
(1分)
![]() (1分)
(1分)
(2)解:![]()
反应后气体的摩尔质量![]() (1分)
(1分)
![]() 的摩尔质量44.0g·mol-1,所以反应后的气体为CO2与CO的混合
的摩尔质量44.0g·mol-1,所以反应后的气体为CO2与CO的混合
气体(注意:不可能是CO与O2或CO2、CO、O2组成的混合气体)(1分)
设CO、CO2的物质的量分别为a、b
由氧原子守恒:![]() ……………………(1)
……………………(1)
由混合气体的摩尔质量:![]() (2分)
(2分)
由方程组(1)(2)可求得:![]() (2分)
(2分)
由碳原子守恒:![]()
![]()