高三化学同步测试(9)—钠镁铝
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分,考试用时120分钟。
可能用到的相对原子质量(原子量):
H-1 C-12 O-16 N-14 Mg-24 K-39 Si-28 Al-27 S-32 Cl-35.5 Na-23
第Ⅰ卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1.定向爆破建筑物时,应同时定向切断钢筋和炸碎水泥,除要用适宜的火药以外,最好还需用 ( )
A.氧快焰 B.铝热剂 C.液氧 D.电弧
2.下列物质不能通过化合反应制得的是 ( )
A.Na2CO3 B.NaHCO3
C.Al(OH)3 D.Fe(OH)3
3.下列物质相互反应能产生可燃性气体的是 ( )
①炭块投入浓硝酸中②铁片投人稀硫酸中③过氧化钠投入水中④电石投入食盐水中
A.①③ B.②④
C.①④ D.②③④
4.鉴别纯碱、石灰石、芒硝、石膏四种白色团体物质,下列试剂中应该选用 ( )
A.NaOH溶液 B. HNO3溶液
C.水和盐酸 D.BaCl2和HNO3混合溶液
5.某溶液中含有 HCO3一、SO32一、CO32一、CH3COO一等 4种阴离子。向其中加入足量的 Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化) ( )
A.CH3COO一 B.SO32一 C.CO32一 D.HCO3一
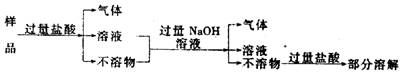 6.现代建筑的门窗框架,常
6.现代建筑的门窗框架,常
用电解加工成古铜色的硬
铝制造。取硬铝样品进行如
下实验:(已知锰比铁活泼),由此推知硬铝的组成是 ( )
A.Al、Mg、Si、Zn B.Al、Cu、Mg、Si、Mn
C.Al、Fe、C、Cu D.Al、Si、Zn、Na
7.纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的是 ( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.用洁净铁丝南取两种样品在煤气火焰上灼烧,使火焰颜色发生明显变化的是小苏打
C.用两只小玻璃杯,分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是小
苏打
D.先将两样品配制成溶液,分别加入石灰水,无白色沉淀生成的是小苏打
8.近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是 ( )
|
A.Mg → Mg(NO3)2
|
|
|
B.Mg → MgC12 → Mg(OH)2 → Mg(NO3)2
|
|
C.Mg → MgO → Mg(NO3)2
|
|
D.Mg → MgSO4 → Mg(NO3)2
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9.正常人胃液的pH在0.3~1.2之间,酸(一般以盐酸表示)多了,需要治疗。某些用以治疗胃酸过多的药物中含 MgCO3、NaHCO3,还有用酒石酸钠来治疗。这主要是由于 ( )
A.对人体而言酒石酸是营养品
B.Na+、Mg2+都是人体必需的元素
C.碳酸、酒石酸都不是强酸
D.MgCO3、NaHCO3与胃酸作用生成 CO2,在服药后有喝汽水的舒服感
10.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律。如:Na2O2+SO2 == Na2SO4、Na2O2+SO3 == Na2SO4+ O2,据此,你认为下列方程式中正确的是
( )
A.2Na2O2+2Mn2O7==4NaMnO4+O2↑
B.Na2O2+2NO2==2NaNO2+O2
C.2Na2O2+2 N2O3==4NaNO2+O2
D.2 Na2O2+2 N2O5 ==4NaNO3+O2
11. 把一小块金属钠投入饱和氨水中,收集到的气体是 ( )
A. 只有氢气 B. 只有氨气
C. 氢气和氨气 D. 只有水蒸气
12.某混合溶液由两种或三种物质溶于水制成,且在溶液中c(K+)= c(Cl-)=![]() c(Na+)=c(SO42一),则溶质可能是) ( )
c(Na+)=c(SO42一),则溶质可能是) ( )
A.KCl、Na2SO4 B.KCl 、Na2SO4 、NaCl
C.K2SO4 、Na2SO4 、NaCl D.K2SO4 、Na2SO4 、KCl
13.2.1g平均相对分子质量为7.2的CO和H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体,固体的质量增加 ( )
A. 7.2g B. 2.1g C. 9.3g D. 以上答案均不正确
14.下列各组离子中,在碱性溶液中共存,且加入盐酸过程中会产生气体和沉淀的是( )
A. Na+、NO3-、AlO2-、SO42- B. Na+、NO3-、SiO32- 、K+
C. K+、Cl-、AlO2-、CO32- D. Na+、Cl一、HCO3一、Ca2+
15.某温度下, MgCl2饱和溶液的质量分数为40%,在足量此溶液中加入4.60无水MgCl2,最终析出水合物晶体40.6g。则该水合物晶体的化学式是 ( )
A.MgC12·7H2O B.MgC12·2H2O
C.MgC12·5H2O D.MgC12·6H2O
16.下列各组物质的溶液,不用其它任何试剂就可以将它们区别开的是 ( )
A.CaC12 、H2SO4、KOH、Ba(NO3)2
B.HCl、MgSO4、Na2SiO3、Ca(NO3)2
C.NH4Cl、NaHSO4、KNO3、NaAlO2
D.Na2CO3 、BaC12 、Na2SO4 、KNO3
17.下列物质发生变化,因反应条件或反应物的用量不同,能够得到不同生成物的是 ① Na和 O2 ②C2H5OH和浓 H2SO4 ③Ca3(PO4)2和 H2SO4 ④AlCl3和 NaOH ⑤Cu和HNO3
( )
A.①③ B.①④⑤ C.除②③外 D.全部
18.下列反应的离子反应方程式正确的是 ( )
A.二氧化碳通入碳酸钠溶液中
CO2+ CO32-+ H2O==2HCO3-
B.氯气通入冷的氢氧化钠溶液中
2Cl2+ 2OH-==3Cl-+ ClO-+ H2O
C.硫酸亚铁溶液加入过氧化氢溶液
Fe2++2H2O2+4H+ ==Fe3++4H2O
D. 适量的稀硫酸滴入偏铝酸钠溶液中
H++ AlO2—十H2O=Al(OH)3↓
第II卷 (非选择题 满分78分)
三、本题包括2小题, 共14分
19.(本小题共6分) 钾与FeSO4溶液反应,很难完整地观察到反应全过程的有关现象。有人用右图装置进行实验改进;先在试管内新制备的FeSO4溶液面上覆盖一薄层汽油,然后将试管放入烧杯中,待试管内汽油层消失后,往试管内投入一小粒钾并迅速塞上带导管的单孔塞。
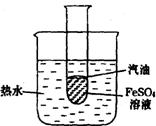 (l)实验中汽油的作用是___________________
(l)实验中汽油的作用是___________________
(2)加入钾后可以观察到:液面上有大量气泡逸出;溶液中有
______________色沉淀生成……
(3 )如果往试管中加入汽油后即投入钾粒,可能发生爆炸事故,
其原因是_________________。
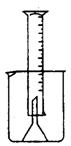 20. (本小题共8分) 测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体
20. (本小题共8分) 测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体
积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实
验常用仪器、800 mL烧杯、100 mL量筒、短颈玻璃漏斗、铜网、铝锌合金
样品、浓盐酸(密度1.19g/cm3)、水。请按右图装置进行实验,并回答下
列问题。(设合金样品完全反应,产生的气体不超过100 mL)
(l)补充下列实验步骤,直到反应开始进行(铁架台和铁圈的安装可省略);
①将称量后的合金样品用铜网小心包裹好,放在800 mL烧杯底部,把短颈漏斗倒扣在样品上面。
②_____________________________________________________________________。
③______________________________________________________________________。
④_______________________________________________。(如有就填写,无则不必填写)
(2)合金样品用铜网包裹的目的是_____________________________________________。
四、本题包括2小题, 共22分
21. (本小题共9分)过氧化氢具有漂白性。某同学研究过氧化钠跟水的反应,进行如下实验:向盛有少量过氧化钠固体的试管中滴加水,直至气体不再放出,加水稀释,将所得溶液平均盛放在两支试管中。一支试管中滴加酚酞试液,溶液变红,半分钟内红色褪去;另一支试管中加入少量二氧化锰,又有气体放出,待气体不再放出后,再滴加酚酞,溶液变红,持久不褪色。请写出:
(1)过氧化钠跟水反应的化学方程式
①_________________________________②______________________________________
(2)加入二氧化锰后发生反应的化学方程式____________________________________,反应中二氧化锰的作用____________________________________。
22. (本小题共13分) (1) 某无色透明的溶液,跟金属铝反应时放出H2,试判断下列离子: Mg2+、 Cu2+、 Ba2+、H+、Ag+、SO42一、HCO3一、OH一、NO3一在下述两种情况中,可能存在于此溶液中的是:
① 当与铝反应后生成Al3+时,原溶液可能存在的离子是____________________
② 当与铝反应后生成AlO2一时,原溶液可能存在的离子是____________________。
(2)拉曼·光谱表明溶液中不存在AlO2-离子,实际存在[Al(OH)4]- 离子,在200mL0.2mol/L Na[Al(OH)4]溶液中逐滴加入0.2mol/L H2SO4溶液250mL,试回答:
①写出分两步反应的离子方程式____________________,_________________________。
②反应完全后,溶液中Al3+离子与SO42-离子的物质的量之比为___________。
五、本题包括2小题, 共21分
23. (本小题共9分) 下图中的每方格表示有关的一种反应物或生成物。反应生成的水已略去。A、B均为短周期元素组成的单质,且B是空气中含量最多的气体。D、F均为无色气体,E为白色沉淀,且不溶于强碱溶液。
![]()
![]()
![]()
![]()
![]()
![]()
![]() A 点燃 H2O →D
F ←
A 点燃 H2O →D
F ←
![]()
![]()
![]()
![]() → C
+D
→ C
+D
![]() B →E ← H ←
B →E ← H ←
![]() +O2
+O2
一定条件
通入O2 H2O
![]()
![]() F
→G
F
→G
(1)A、B两单质反应的化学方程式为__________________。
(2)写出G→F的化学方程式_________________________________________。
(3)写出H→E的离子方程式______________________________。
24. (本小题共12分) 某金属A在一定的条件下,发生如图所示一系列变化。由此推断:(填名称) A是___________,C是_________,E是______________,G是_______。写出下列化学反应方程式或离子反应方程式:
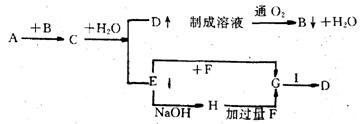
①C+H2O_______________________________
②G+I+H2O______________________________________________
六、本题包括2小题, 共21分
25. (本小题共8分) 取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0 470 g, 冷却后加人足量水,将反应产物加热蒸干并灼烧。得到的氧化镁质量为0. 486g
(1)写出氮化镁与水反应生成氢氧化镁和氨的化学方程式。
(2)计算燃烧所得混合物中氮化镁的质量分数。
26.(本小题共13分) 现有NaOH和NaHCO3固体混合物0.2 mol,在密闭容器中加热到
250℃,让其充分反应后,排出气体、冷却,称得残留固体质量为a g。
(1)写出可能发生的反应的化学方程式。_________________________________
_____________________________________________________________________。
(2)设混合物中 NaOH为x mol(0<x<0.2=,问 x为不同值时残留固体为何种物质,并计算a的数值(可以用包含x的式子表示),填表回答:
| x值 | 残留固体(化学式) | a值 |
参考答案及评分标准(九)
一、二选择题(1~18小题每题4分,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | C | A | C | A | B | C | C | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AD | C | AC | B | C | D | C | D | AD |
19. ⑴受热时汽油气化, 其蒸气将试管中空气排尽。 ⑵白 ⑶钾迅速与水反应生成氢气,并放热, 引燃混合后的氢气、汽油、空气,易发生爆炸。(6分)
20.⑴②烧杯中盛少量水, 量筒中盛满水, 将量筒倒扣漏斗上(如图)
③向烧杯中注入浓盐酸 ④充分反应、冷却后, 读出量筒的读数(6分)
⑵形成Zn-Cu原电池, 加快反应速率。(2分) 本题共8分
21.⑴① 2Na2O2+2H2O=4NaOH+ O2↑ ② Na2O2+2H2O=2NaOH+ H2O2(6分)
|
⑵ 2H2O2 == 2H2O+ O2↑ 催化剂(3分) 本题共9分
22.⑴①Mg2+、 SO42一、H+ ② Ba2+、OH一、NO3一(4分)
⑵① [Al(OH)4]- + H+= Al(OH)3 ↓+ H2O(3分)
Al(OH)3+ 3H+ ==Al3++3 H2O(3分)
②2:5(3分) 本题共13分
|
23.⑴ 3N2+2Mg = Mg3N2 ⑵ 3NO2 + H2O=2HNO3 +NO
⑶Mg2++2NH3·H2O==Mg(OH)2 ↓+3NH4+(9分)
24.A:铝,B: 硫化铝,E:氢氧化铝,G:氯化铝 (8分) ① Al2S3+ 6H2O==2Al(OH)3+3H2S↑(2分)
②2Al3++3S2- +6H2O==2Al(OH)3+3H2S↑(2分) 本题共12分
25.解: ⑴ Mg3N2+ 6H2O==3Mg(OH)2+ 2NH3↑(3分)
⑵ Mg3N2 ~ 3MgO △m
100g 48g-28g=20g
(0.0800g) 0.486g-0.470g=0.0160g
ω(Mg3N2)=0.080g/0.470g ×100%=17.0%(5分)
答: 略 本题共8分
|
26. 解: ⑴NaOH+NaHCO3 =Na2CO3+ H2O 2NaHCO3 == Na2CO3+ H2O+CO2↑(4分)
(2NaOH+ CO2=Na2CO3+ H2O)
⑵ 设NaOH和NaHCO3恰好反应, 即x=0.1mol
NaOH + NaHCO3 = Na2CO3+ H2O
0.1mol 0.1mol 0.1mol
a=10.6
当0.2>x>0.1时NaOH过量
NaOH + NaHCO3 = Na2CO3 + H2O
(0.2-x)mol (0.2-x)mol (0.2-x)mol
a=106×(0.2-x)+40×[x-(0.2-x)]=13.2-26x
当0<x<0.1时 ⑴中两反应共存, 生成的残留固体是Na2CO3, 共含0.1mol(钠元素守恒)
a=10.6
| x值 | 残留固体(化学式) | a值 |
| 0.1 | Na2CO3 | 10.6 |
| 0.2>x>0.1 | NaOH、Na2CO3 | 13.2-26x |
| 0<x<0.1 | Na2CO3 | 10.6 |
(9分)
答:略 本题共13分