高三化学同步测试(15)—计 算
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分,考试用时120分钟。
可能用到的相对原子质量(原子量): H -1 C-12 O-16 N -14 Ca -40 Na -23 Mg-24 Zn-65 Cu-64 Al-27 Be-8 Fe-56
第Ⅰ卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1.录像带用的磁粉中有 CoFe3-xO3+x,其中钴和铁可有+2、+3的某一种价态,正确的是①x=1②x=2 ③含![]() ④含
④含![]() ⑤含
⑤含![]() ⑥含
⑥含![]() ( )
( )
A.①③⑤ B.②③⑥
C.②③⑤ D.①③⑥
2.某地酸雨经检测除H+和OH-外,还含有Na+、Cl一、NH4+、SO42一,其浓度分别为c(Na+)=7×10-6mol/L, c(Cl一)=3.5×10-5mol/L,c(NH4+)=2.3×10-5mol/L, c(SO42-)=2.5×10-6 mol/L。则该酸雨的pH是 ( )
A.3 B.4 C.5 D.6
3.将0.3 mol Cu2S与足量稀硝酸混合在加热条件下反应,生成产物为硝酸铜、硫酸、一氧化氮和水。则在参加此反应的硝酸中, 被还原的硝酸的物质的量 ( )
A. 1.0 mol B. 1.2 mol C. 1.6mol D. 2.2 mol
4.W g NaHCO3加热分解一段时间后质量变为 m g, 则NaHCO3的分解率为 ( )
A. ![]() × 100%
B.
× 100%
B. ![]() × 100%
× 100%
C. ![]() × 100%
D.
× 100%
D. ![]() × 100%
× 100%
5.燃烧镁和某金属组成的合金,所生成的氧化物的质量为原合金质量的2倍,则另一种金属可能是 ( )
A.铜 B. 铍 C.钠 D.铝
6.将10.5 g锌、铁、镁粉混合物与一定量的质量分数为25%的稀硫酸恰好完全反应,蒸干溶液后得固体(不含结晶水)29.7g., 则产生氢气的质量为 ( )
A. 1.92g B.0.2g
C.0.4g D. 无法求得
7.取1.5 mol/L H2SO4 11.5 rnL,投入 0.4 g镁条充分反应后,再滴入1.0mol/L烧碱溶液将Mg2+全部转为沉淀.则烧碱溶液的用量至少为 ( )
A.23 mL B.34.5mL
C.43.5 mL D.30.5 mL
8.天平两托盘上分别放置盛有同浓度、同体积的稀硫酸的烧杯,天平平衡。今向一杯中投入铝片,另一杯中投入镁片,且铝、镁片均完全溶解,若要天平仍保持平衡,则铝、镁的物质的量之比为 ( )
A.1 : 1 B.11:12 C.9 :8 D.12 : 11
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有1或2个选项符合题意。若正确答案只包括一个选项, 多选时, 该题为0分; 若正确答案只包括两个选项, 只选一个且正确的给2分, 选两个都正确的给4分, 但只要选错一个, 该小题就为0分)
9.标准状况下将盛满NO、NO2、O2混合气的集气瓶倒置于水槽中,完全溶解, 无气体剩余。则所得溶液物质的量浓度c数值范围为(设产物不扩散) ( )
A.0 < c<![]() B.
B.![]() < c<
< c<![]()
C.![]() < c<
< c< ![]() D.
D.![]() < c<
< c< ![]()
10.1.01×105Pa、150℃时,将1L C2H4、2L C2H2和2L C2H6与20L O2混合点燃, 完全反应后恢复至原状况、气体体积为 ( )
A.10 L B.15L C.20L D.25L
11.某温度下,W g某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应, 固体质量增加W g,在①H2,③CO,③CO和H2混合气,④HCHO, ⑤CH3COOH, ⑥HOCH2CH2OH中符合题意的是 ( )
A.均不符合 B.只有①②③
C.只有④⑤ D.全部符合
12. 1.92 g铜投入一定量的浓硝酸中,铜完全溶解,共收集到 672 mL气体(标准状态下),将盛有此气体的容器倒扣在水中,通入一定量的O2(标准状态下)。恰好使气本完全溶于水中,则通入O2的体积是 ( )
A.504 mL B.168 mL C. 336 ml D. 224 mL
13. 密度为0.91g/cm3的氨水,溶质质量分数为25%,该氨水用等体积水稀释后,所得溶液的溶质质量分数是 ( )
A. 等于12.5% B. 大于12.5%
C. 小于12.5% D. 无法确定
14. 某元素(无可变价) 的硫酸盐的式量是M, 硝酸盐的式量是N, 则该元素的化合价是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
15.取一定量的甲烷与少量氧气混合点燃,生成CO、CO2和水蒸气的混合物49.6g,将燃烧混合物缓缓通过无水氯化钙并吸收完全,氯化钙的质量增加25.2g,由此可知甲烷不完全燃烧所得产物中一氧化碳的质量是 ( )
A. 11.2g B.8.4g C. 5.6g D.28g
16. 在含有a mol Ca(OH)2的澄清石灰水中,缓缓通入b mol CO2,观察到白色沉淀从无到有,从少到多, 又从多到少三个阶段, 则最后得到的白色沉淀的质量是 ( )
A. 100(b-a) g B. 100(2a-b) g C. 100(a-b) g D. 100(2b-a) g
17.将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83gX中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应, 得到3.81g I2, 反应中Cr2O72-又生成2Cr3,若向溶有2.83gX的溶液中加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为 ( )
A.K2SO4·2Cr2(SO4)3 B.2K2SO4·Cr2(SO4)3
C.K2SO4·Cr2(SO4)3 D.3K2SO4·Cr2(SO4)3
18. 将8gFe2O3投入150 mL某浓度的稀硫酸中,再投入7g铁粉,共收集到1.68LH2(标况),同时Fe和Fe2O3均无剩余。向溶液中滴入KSCN溶液,未见颜色变化。为了中和过量的H2SO4,且使Fe2+恰好完全转化为Fe(OH)2沉淀,共消耗4mol/L的NaOH溶液150mL。则原H2SO4的物质的量浓度为 ( )
A.1 mol/L B. 2 mol/L C.3 mol/L D. 4 mol/L
第II卷(非选择题 满分78分)
三、本题包括2小题, 共19分
19. (本小题共7分) 在火箭推进器中装有强还原剂液态肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混和时,即产生大量氮气和水蒸气,并放出大量热。已知 0.4 mol N2H4和足量H2O2(液)反应,生成氮气和水蒸气,放出 256.65KJ的热量。
(1) 写出反应热化学方程式:_______________________________________________
(2)已知:H2O(l)= H2O(g); △H= 44KJ/mol,则 16g液态N2H4与足量液态H2O2反应生成N2和液态水放出的热量是______________KJ。
(3)上述反应应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很突出的优点是______________________________________________________________。
20. (本小题共12分) 已知:AgF+Cl2 +H2O→AgCl+AgClO3+O2+HF(未配平)
(1)若Cl2的化学计量数为a,则AgF的化学计量数为______;判断的依据是_________
__________________________________________________________;若AgClO3的化学计量数为b,O2的化学计量数为c,则AgCl的化学计量数为_________________;判断的依据是_________________________________________________________________。
(2)该反应的氧化产物是______________,每有 1 mol水被氧化,被水还原的氧化剂的物质的量为________________________________。
四、本题包括2小题, 共19分
21.(本小题共5分) 用K35ClO3和H37Cl反应生成KCl和Cl2及水, 生成的Cl2相对分子质量是__________。
22. (本小题共14分) A为烃,B是烃的含氧衍生物。由等物质的量的 A和B组成的混合物0.05mo1在0.125ml的氧气中恰好完全燃烧,生成0.1 molCO2和0.l molH2O。试通过计算回答:
(1)从化学式的角度看,该混合物组合有几种可能?____________________________种
(2)另取A和B以任意物质的量之比的混合物,且混合物的物质的量为定值。使其完全燃烧;
①若耗氧量一定,则A、B的化学式分别是______________、_________________
②若生成的CO2和H2O的物质的量一定,则A、B的化学式分别是_______________、______________________
(3)另取a mol的以任意比混合的A和B的混合物,在过量的氧气中使之完全燃烧:
①若耗氧量为定值,则该值为_____________mol(用含a的代数式表示,下同);
②若生成物CO2的量为定值,则生成物水的质量范围为____________。
五、本题包括2小题, 共20分
23.(本小题共10分) 取3.40g只含羟基不含其它官能团的液态饱和多元醇,置于5.00L氧气中,经点燃,醇完全燃烧。反应后气体体积减少0.56L。将气体经 CaO吸收,体积又减少2.80L(所有体积均在标准状况下测定)。
(1)该醇中C、H、O的原子数之比为________________________;
(2)由以上比值______(填“能” 、“不能”) 确定该醇的化学式,其原因是________
____________________________________________________________
(3)如果将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物只有一种,试写出该饱和多元醇的结构简式。
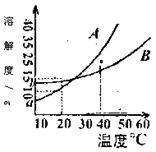
24.(本小题共10分) A、B化合物的溶解度曲线如右图。现要用结
晶法从A、B混合物中提取A(不考虑A、B共存时对各自溶解
度的影响) 。
(1) 取50g混合物,将它溶于100g热水,然后冷却至20℃。若要
A析出而B不析出,则混合物中B的质量分数(B%)最高不
能超过___________。
(2) 取w g混合物,将它溶于100g热水,然后冷却至10℃。若仍要A析出而B不析出,请写出下列两种情况下,混合物中A的质量分数(A%)应满足的关系式。
①当 w <a+ b时, A%___________;(以w、a 、b表示);
②当 w >a+ b时, A%______________。
六、 本题包括2小题, 共20分
25.(本小题共10分) 12.6g亚硫酸钠固体投入到100mL8mol/L硫酸溶液中, 充分反应溶液中溶有+4价硫的溶质的物质的量浓度是0.2mol/L, 假设溶液的体积仍为100mL。 问(1) 反应后溶液中硫的质量是多少? (2)生成的气体体积是多少毫升?(假设在标准状态下)
26.(本小题共10分) 有一混合溶液含有 a mol Fe2(SO4)3和 b mol CuSO4,与铁粉发生的可能的离子反应方程式有:
___________________________________,____________________________,当其充分反应后,生成FeSO4的物质的量n(mol)及溶液中沉淀析出金属粉末的质量w(g)随加入铁粉的量m (mol) 而变化,请填写下表:
| 铁粉m (mol) | FeSO4 n(mol) | 金属粉末w(g) |
| (1)m>a+b | ||
| (2) | n=3m | |
| (3) | W=64b |
参考答案及评分标准(十五)
一、二选择题(1~18小题每题4分,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | C | A | C | B | C | B | B | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | D | C | C | AB | A | B | C | B |
19. ⑴N2H4(l)+2H2O2(l)==N2(g)+4H2O(g); △H = -641.6kJ/mol(3分)
⑵ 408.8kJ(2分)
⑶ 产生N2和H2O, 不污染环境。(2分) 本题共7分
20. ⑴2a, 质量守恒, 5b+4c, 电子得失守恒(8分)
⑵ AgClO3、O2 , 1mol(4分) 本题共12分
21. 73.3(5分)
22. ⑴ 5(3分)
⑵①C2H2,C2H6O2 ② C2H4 , C2H4O2(4分)
⑶①2.5a (3分) ②18a<m(H2O)<54a(4分) 本题共14分
23. ⑴ 5:12:4(3分)
⑵能, 该醇分子最简式已饱和, 最简式就是分子式(4分)
⑶C(CH2OH)4(3分) 本题共10分
24.⑴30% (4分) ⑵ ①>a/w(3分) ②>1-a/w(3分) 本题共10分
25.解: ⑴n(H2SO4)=0.1L×8mol/L=0.80mol
+4价硫的物质的量n=0.1L×0.2mol/L=0.020mol
m(S)=(0.80mol+0.02mol)×32g/mol=26.2g(5分)
⑵n(Na2SO3)=12.6g/126g·mol-1=0.10mol
V(SO2)=(0.10mol-0.02mol)×22.4L/mol=1.792L=1792mL(5分)
答: 略 本题共10分
26. 解:Fe+2Fe3+=3Fe2+ Fe+Cu2+= Fe2++Cu(4分)
⑴m>a+b时, 铁剩余
Fe+2Fe3+=3Fe2+ Fe+Cu2+= Fe2++Cu
a 2a 3a b b b b
n(Fe2+)=3a+b w=(m-a-b)×56+b×64
⑵n(Fe2+)=3m时, 铁把Fe3+恰好反应,m=a w=0
⑶w=64b时, 铜离子恰好完全被还原,m=a+b n(Fe2+)=3a+b
| 铁粉m (mol) | FeSO4 n(mol) | 金属粉末w(g) |
| (1) | 3a+b | 56m-56a+8b |
| (2)m=a | 0 | |
| (3)m=a+b | 3a+b |
(6分)
答: 略 本题共10分