高三化学全国统一标准测试(二)
命题范围:物质结构,元素周期律,晶体的类型与性质,硫和硫的化合物,硫酸工业,硅和硅酸盐工业。
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分,考试时间90分钟。
可能用到的相对原子质量:H 1 O 16 C 12 N 14 Na 23 Si 28 S 32 Cl 35.5 Ca 40
第Ⅰ卷
(选择题 共20题 1~10题每题2分 11~20题每题3分 共50分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。
1.当今化学界关注的热点之一的C60,它可以看成是金刚石的
A.同素异形体 B.同分异构体
C.同位素 D.同系物
2.导致下列现象的主要原因与排放SO2有关的是
A.酸雨 B.光化学烟雾
C.臭氧空洞 D.温室效应
3.19世纪中叶,门捷列夫的突出贡献是
A.提出原子学说 B.发现元素周期律
C.提出分子学说 D.发现氧气
4.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是
A.半导体材料砷化镓 B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌 D.超导材料K3C60
5.下列物质固态时,必定是分子晶体的是
A.酸性氧化物 B.碱性氧化物
C.非金属单质 D.含氧酸
6.![]() X是X的一种同位素,则元素X在周期表中的位置是
X是X的一种同位素,则元素X在周期表中的位置是
A.第4周期第ⅤA族 B.第4周期第ⅦA族
C.第3周期第ⅦA族 D.第5周期第ⅠA族
7.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是
A.x+2 B.x+4
C.x+8 D.x+18
8.将木炭与浓硫酸共热后得到的气体通入下述溶液中,不会得到无色澄清溶液的是
A.品红溶液 B.饱和H2S溶液
C.BaCl2溶液 D.溴水
9.下列属于新型无机非金属材料特性的是
①能承受高温,强度高;②具有电学特性;③具有光学特性;④具有生物特性;⑤可塑性好。
A.① B.①②
C.①②③⑤ D.①②③④
10.1999年美国《科学》杂志报道:在40 GPa高压下,用激光器加热到1800 K,人们成功制得了原子晶体干冰,下列推断不正确的是
A.原子晶体干冰有很高的熔点、沸点
B.原子晶体干冰易气化,可用作制冷材料
C.原子晶体干冰硬度大,可用作耐磨材料
D.每摩尔原子晶体干冰中含4 mol C—O键
11.下列物质所发生的化学反应中,由于反应物的用量不同而得到不同产物的是
①H2S+O2;②P+Cl2;③P2O5+H2O;④NaCl(固)+H2SO4(浓);⑤AlCl3+NaOH;⑥乙醇和浓硫酸;⑦SO2+H2S;⑧碳酸钠和稀盐酸;⑨硫和氧气;⑩H2S+NaOH
A.全部都是 B.①②⑤⑧⑩
C.①②⑤⑦⑧⑩ D.①②④⑤⑦⑧⑨⑩
12.过氧化氢的沸点比水高,但受热容易分解。某试剂厂把7%~8%的过氧化氢溶液浓缩成30%的溶液时,可采用的方法是
A.常压分馏 B.减压分馏
C.加生石灰常压分馏 D.加压分馏
13.某固体仅由一种元素组成,其密度为5.0 g·cm-3,用X射线研究该固体的结构得知:在边长为10-7 cm的正方体中有20个原子,则此元素的相对原子质量接近于
A.32 B.120
C.150 D.180
14.某盐Na2R2O3·5H2O遇酸分解,具有还原性,R2O![]() 的结构如图所示。其中两个R处于不同的价态,则R①和R②的价态分别是
的结构如图所示。其中两个R处于不同的价态,则R①和R②的价态分别是
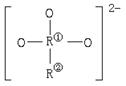
A.+3,-1 B.+6,-2
C.+4,-1 D.-3,+1
15.关于化学键的下列叙述中,正确的是
A.离子化合物不含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.共价化合物中不含离子键
16.为提高SO2的转化率,通常使用过量的空气,使SO2充分氧化。故从接触室出来的混合气体含有
A.SO3,O2 B.SO3,O2,N2
C.SO3,N2 D.SO3,SO2,O2,N2
17.下列叙述正确的是
A.同周期元素的原子半径ⅦA族的为最大
B.在周期表中ⅠA族元素的单质全部是金属
C.ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子
D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等
18.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是
A.X的原子序数比Y的小
B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大
D.X元素的最高正价比Y的大
19.某离子晶体晶胞结构如下图所示,图中X位于立方体的顶点,Y位于立方体中心。晶体中距离最近的2个X与一个Y形成的夹角∠XYX的角度为
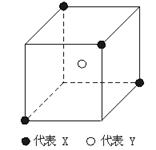
A.109°28′ B.107°18′
C.90° D.120°
20.下图是一套检验气体性质的实验装置,向装置中缓慢通入气体X,若关闭活塞,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞,则品红溶液褪色。据此判断气体X和洗气瓶内溶液Y分别可能是
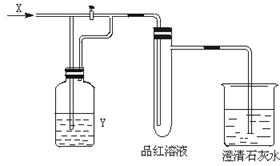
| A | B | C | D | |
| X | SO2 | H2S | CO2 | Cl2 |
| Y | 饱和NaHCO3溶液 | 浓硫酸 | Na2SO3溶液 | Na2SO3溶液 |
全国统一标准测试
化 学
第Ⅱ卷
(非选择题 共8题 共50分)
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 总分 |
| 分数 |
21.(5分)请写出10个分子式,使每个分子中都含有18个电子。
、 、 、 、
、 、 、 、
、 。
22.(6分)位于同一周期的X、Y、Z三种元素,原子序数依次增大,最外层电子数之和为10。它们的最高价氧化物的水化物之间,任意两种都能反应生成盐和水。M元素与上述三种元素位于相邻的周期,而M原子的L电子层上有4个电子。试写出:
(1)X、Y、Z、M的元素符号:X ,Y ,Z ,M ;
(2)Y位于元素周期表中第 周期,第 族;
(3)Z的原子结构示意图为 ;
(4)M的最高价氧化物是含 键的 分子(填极性或非极性);
(5)X与Z组成的化合物的电子式为 。
23.(5分)化工厂的选址是一个复杂的问题,要考虑多方面的因素。某省拟在A、B两个相邻的城市中选择,建一个硫酸厂,两城市的条件如下:
A城市:①这是一个风光秀丽的旅游城市,土地价格较贵;②有丰富的黄铁矿资源,水源、能源充足,交通方便;③该城市使用硫酸的工业不多。
B城市:①人口较少,是重要的农业区;②有丰富的磷石矿藏,主要工业产品是铅蓄电池和过磷酸钙;③道路交通比较发达。
根据两城市的条件,回答下列问题:
(1)如果硫酸厂建在A城市,A城市的优势是 ,不利的方面是 ;
(2)如果硫酸厂建在B城市,B城市的优势是 ,不利的方面是 ;
(3)如果你是决策者,你会将硫酸厂建在 (填“A”或“B”)城市。
24.(6分)A~Ⅰ间的反应关系如图所示。已知单质 Ⅰ 可作为半导体材料;单质G是密度最小的气体;化合物H是无色无臭的有毒气体,能在空气中燃烧;化合物E极易溶于水形成无氧酸,该酸在常温下能与氧化物A起反应。
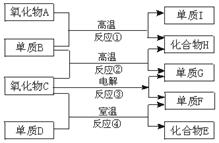
(1)氧化物A的化学式是 ;
(2)化合物E的电子式是 ;
(3)反应①的化学方程式是 ;
(4)反应④的化学方程式是 。
25.(10分)某学生做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象。
Ⅰ.实验方案
1.用砂纸擦净的镁带与沸水反应,再向反应液中滴加酚酞试液
2.向新制的H2S饱和溶液中滴加新制的氯水
3.钠与滴有酚酞试液的冷水反应
4.镁带与2 mol·L-1的盐酸反应
5.铝条与2 mol·L-1的盐酸反应
6.向氯化铝溶液中滴加NaOH溶液
Ⅱ.实验现象
A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变红色
B.产生大量气体,可在空气中燃烧,溶液变成浅红色
C.反应剧烈,产生气体可燃烧
D.剧烈反应,产生气体能在空气中燃烧
E.生成白色沉淀,继而沉淀消失
F.生成淡黄色沉淀
现在请你帮助该学生整理并完成实验报告。
(1)实验目的:验证同周期元素性质的递变规律
(2)实验用品:仪器:试管、砂纸、镊子、滤纸、小刀、 、 药品:(略)
(3)实验内容(在下列空格内填写相关内容)
| 实验方案顺序 | 实验现象 | 有关反应的化学方程式 |
| 3 | A | |
| E | ||
| 2 |
(4)实验结论: 。
(5)问题和讨论:
①请用结构理论简单说明得出上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另外两种元素性质的递变规律。
26.(9分)SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下实验装置:
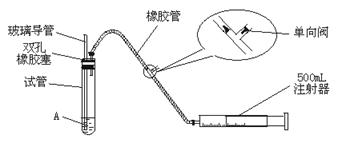
(1)检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后 (填写操作方法)时,将会看到 (填写实验现象),则证明该装置的气密性良好。
(2)向试管中加入0.0005 mol·L-1的碘水1.0 mL,用适量的蒸馏水稀释后再加入2~3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由 色变为 色时反应恰好完全进行,此时停止抽气,该反应的化学方程式为 。
(3)我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值如下表:
| 浓度限值/mg·m-3 | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A,在同一地点、同时测量空气中SO2的含量。当反应恰好完全进行,记录抽气次数如下(假设每次抽气500 mL)。请将下表填写完整(计算时保留2位有效数字):
| 分组 | 第一小组 | 第二小组 |
| 抽气次数 | 120 | 140 |
| SO2含量/mg·m-3 |
|
判断该地点的空气中SO2的含量属于 (填数字)级标准, (“第一”或“第二”)小组的测定结果正确,另一小组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题) 。
27.(4分)某化工厂每小时生产98%(质量分数)硫酸a t(吨),为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气 体中含氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则
(1)该厂每小时消耗标准状况下空气的体积为 m3。
(2)为满足题设需求,b%的下限等于 。
28.(5分)已知高温下能发生如下反应:SiO2+2C![]() Si+2CO,Si+C
Si+2CO,Si+C![]() SiC。现有石英砂和碳粉的混合物a mol,在高温电炉中隔绝空气充分反应,反应完全后,冷却得到残留固体。若石英砂与混合物的物质的量之比为x(0<x<1),试讨论x的取值范围,残留固体的成分和物质的量,并将结果填入下表中:
SiC。现有石英砂和碳粉的混合物a mol,在高温电炉中隔绝空气充分反应,反应完全后,冷却得到残留固体。若石英砂与混合物的物质的量之比为x(0<x<1),试讨论x的取值范围,残留固体的成分和物质的量,并将结果填入下表中:
说明:①残留固体物质的量用a,x等表示,不必列出具体的计算式。
②每组空格填一种情况,有几种填几种,不必填满。
| x值 | 残留固体 | |
| 分子式(或化学式) | 物质的量/mol | |
高三化学全国统一标准测试(二)答案
1.A 2.A 3.B 4.C 5.D 6.D 7.B 8.B 9.D 10.B 11.B 12.B 13.C 14.B 15.D 16.D 17.C 18.C 19.A 20.A
21.(5分)Ar、F2、HCl、H2S、PH3、SiH4、H2O2、N2H4、C2H6、CH3OH、CH3NH2(任选10种)
22.(6分)(1)Na Al S C (2分)
(2)三 ⅢA (1分)
(4)极性 非极性 (1分)
![]()
23.(5分)(1)黄铁矿资源丰富,水源、能源充足,交通方便 旅游城市,环境保护要求高,土地价格贵,使建厂的成本高,使用硫酸的工业少,运输的成本高 (2分)
(2)有消耗大量硫酸的工厂,交通运输比较发达,人口对环保的要求低,主要是农业区,土地的成本较低 本地没有制硫酸的原料黄铁矿 (2分)
(3)B (1分)
24.(6分)(1)SiO2 (1分)
![]()
(3)SiO2+2C![]() Si+2CO (2分)
Si+2CO (2分)
(4)2F2+2H2O===4HF+O2 (2分)
25.(10分)(2)酒精灯 胶头滴管 (1分)
(3)2Na+2H2O===2NaOH+H2↑,
1 B Mg+2H2O===Mg(OH)2+H2↑,
4 D Mg+2HCl===MgCl2+H2↑,
5 C 2Al+6HCl===2AlCl3+3H2↑,
6 AlCl3+3NaOH===Al(OH)3↓+3NaCl Al(OH)3+NaOH===NaAlO2+2H2O
F H2S+Cl2===S↓+2HCl (5分)
(4)随原子序数递增,Na、Mg、Al、S、Cl元素的金属性逐渐减弱,非金属性逐渐增强 (1分)
(5)①同周期从左到右,随着原子序数的递增,原子半径逐渐减小,原子核对外层电子吸引力逐渐增强,因而原子失电子能力逐渐减弱,得电子能力逐渐增强,表现在化学性质上,元素的金属性逐渐减弱,非金属性逐渐增强。
②另两种元素是Si和P,设计方案为:向硅酸钠溶液中加入磷酸溶液,有白色沉淀生成,说明磷酸的酸性比硅酸强,即非金属性:P>Si。(3分)
26.(9分)(1)轻轻抽拉注射器的活塞 浸没在水中的玻璃导管口有气泡冒出 (2分)
(2)蓝 无 I2+SO2+2H2O===2HI+H2SO4 (2分)
(3)0.53 0.46 三 第一 抽气速度过快,造成空气中SO2无法与碘水充分反应,产生较大的误差 (5分)
27.(4分)(1)22400a/(21-b) (2分) (2)7% (2分)
28.(5分)①x>1/3 SiO2 Si a(3x-1)/2 a(1-x)/2 (1分)
②x=1/3 Si a/3 (1分)
③1/3>x>1/4 Si SiC a(4x-1) a(1-3x) (1分)
④x<1/4 SiC C ax a(1-4x)(1分)
⑤x=1/4 SiC a/4(1分)