高三化学全国统一标准测试(三)
命题范围: 氮族元素、化学平衡、电离平衡
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分,考试时间90分钟。
第Ⅰ卷
(选择题 共18题 1~9题每题2分 10~18题每题3分 共45分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。
下列各题的四个选项中,只有一个选项是最符合题目要求的
1.现有下列物质:①氯水、②氨水、③浓硝酸、④溴,其中必须保存在棕色瓶里的是
A.全部 B.①③和⑤
C.只有①和③ D.①②和④
2.为防止水源的污染,最近,政府部门决定对市售洗衣粉的成分加以限制,严禁销售和使用的洗衣粉中主要是因为含有
A.蛋白酶 B.碱
C.磷的化合物 D.香料
3.安全火柴盒的侧面所涂的物质是某一混合物,其中含有
A.白磷和三硫化二锑 B.红磷和三硫化二锑
C.氯酸钾、二氧化锰和硫 D.硝酸钾、二氧化锰和硫等
4.在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A.单位时间内生成n mol A2的同时生成n mol AB
B.容器内的总压强不随时间变化
C.单位时间内生成2n mol AB的同时生成n mol B2
D.单位时间内生成n mol A2的同时生成n mol B2
5.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,从下表中选出正确选项
(甲为酸式滴定管,乙为碱式滴定管)
锥形瓶中溶液 滴定管中溶液 选用指示剂 选用滴定管
A.碱 酸 石蕊 乙
B.酸 碱 酚酞 甲
C.碱 酸 甲基橙 甲
D.酸 碱 甲基红 甲
6.砷为第四周期第ⅤA族,根据砷在周期表中的位置推测,砷不可能具有的性质是
A.砷在通常情况下是固体
B.As2O5对应水化物酸性比H3PO4弱
C.可以有-3、+3、+5等多种化合价
D.AsH3比PH3稳定
7.一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器内,充分反应后,容器内残留m/2体积的气体。该气体接触空气则变为红棕色。则m与n的比值为
A.8∶3 B.2∶3
C.3∶2 D.3∶8
8.用已知浓度的NaOH溶液滴定未知浓度的醋酸溶液,下列操作中会使测定结果偏低的有
A.以甲基橙作指示剂
B.锥形瓶沾有少量水
C.滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失
D.滴定前俯视滴定管读数,滴定后平视刻度读数
9.下列微粒在溶液中能大量共存的是
A.NH![]() 、Fe2+、SO
、Fe2+、SO![]() 、NO
、NO![]()
B.Mg2+、K+、Cl-、AlO![]()
C.Al3+、Na+、SO![]() 、HS-
、HS-
D.Ca2+、H+、NO![]() 、S2O
、S2O![]()
10.将pH=1的盐酸平均分成两份,1份加适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为
A.9 B.10 C.11 D.12
11.常温时,pH=1的两种一元酸溶液A和B,分别加水稀释1000倍,两溶液的pH与所加水的体积变化如图1所示,下列结论中正确的是
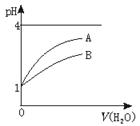
图1
A.中和相同体积、相同物质的量浓度的NaOH需用的两种酸的体积相同
B.B酸比A酸容易电离
C.B是弱酸,A是强酸
D.pH=1时,B酸的物质的量浓度比A酸大
12.下列反应的离子方程式正确的是
A.FeO与稀HNO3反应:FeO+2H+===Fe2++H2O
B.FeCl3溶液中通入H2S气体:2Fe3++H2S===2Fe2++S↓+2H+
C.NH4Cl固体加入极稀NaOH溶液中:NH![]() +OH-===NH3↑+H2O
+OH-===NH3↑+H2O
D.氯化铵固体和熟石灰共热
NH![]() +OH-===NH3↑+H2O
+OH-===NH3↑+H2O
13.在密闭定容容器中有可逆反应:mA(g)+nB(g)![]() pC(g);处于平衡状态,又知,m+n>p,正反应为吸热反应,则下列说法正确的是
pC(g);处于平衡状态,又知,m+n>p,正反应为吸热反应,则下列说法正确的是
①升高温度c(B)/c(C)的比值减小 ②降温时体系内混合气体平均相对分子质量减小
③加入B,A的转化率变大 ④加入催化剂,气体的总物质的量不变 ⑤充入C,则A、B的物质的量增大
A.③④ B.①②⑤ C.②③⑤ D.全部
14.向10 mL 0.1 mol/L的Na2CO3溶液中通入22.4 mL(标况)CO2,当气体全部溶解时,溶液中粒子浓度关系正确的是
A.c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.c(HCO![]() )=c(Na+)>c(OH-)>c(H+)
)=c(Na+)>c(OH-)>c(H+)
C.c(Na+)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(H2CO3)
)+c(H2CO3)
D.c(OH-)=c(HCO![]() )+2c(H2CO3)+c(H+)
)+2c(H2CO3)+c(H+)
15.常温下,向0.1 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图2所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是
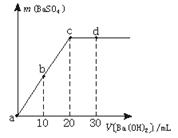
图2
A.溶液的pH:a<b<c<d B.溶液的导电能力:a>b>d>c
C.a、b溶液呈酸性 D.c、d溶液呈碱性
16.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛,其化学机理为:
①HUr+H2O![]() Ur-+H3O+
Ur-+H3O+
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq)![]() NaUr(s)
NaUr(s)
下列对反应②的叙述中正确的是
A.反应的ΔH>0 B.升高温度平衡向正反应方向移动
C.反应的ΔH<0 D.降低温度平衡向逆反应方向移动
17.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法正确的是
A.甲烧杯中放入锌的质量比乙烧杯中放入锌粒的质量小
B.甲烧杯中的酸过量
C.两烧杯中参加反应的锌的质量相等
D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
18.同时对农作物施用含氮、磷、钾的三种化肥,对给定的下列化肥:①K2CO3,②KCl,③Ca(H2PO4)2,④(NH4)2SO4,⑤氨水。最适当的组合是
A.①③④ B.②③④
C.①②⑤ D.②③⑤
全国统一标准测试
化 学
第Ⅱ卷
(非选择题 共7题 共55分)
| 题 号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 总 分 |
| 分 数 |
19.(5分)利用图3所示装置比较不同电解质在水溶液里电离能力的大小。
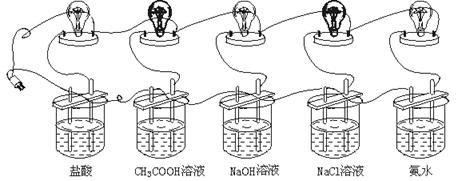
图3
请回答有关问题:
(1)下列不会影响电解质在溶液中电离程度的因素有 。
A.电解质的成键类型
B.电解质本身的颜色
C.溶解电解质所用溶剂的种类
D.电解质溶液的温度
E.电解质溶液的浓度
F.电解质在通常情况下的存在状态
G.外界环境的压强
(2)为了探究不同电解质之间电离能力的差异,课本上设计了上述实验,通过观察灯泡的明亮程度,判断电解质的电离能力大小,为此必须控制其他能影响灯泡亮度的一些因素,使之保持一致,从而不影响灯泡的明亮程度。在本实验中,采取了哪些主要措施来控制其他因素对灯泡亮度的影响?(写出三条即可)
20.(10分)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作是 (填“正确的”或“错误的”),其理由是 。
(2)如不正确请说明理由,同时请分析是否一定有误差?答 。
(3)若用此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是 。
21.(7分)有mA(g)+nB(g)![]() 3C(g)平衡体系,在不同条件下,反应混合物中A、B、C的体积分数和时间t的关系如图4所示:
3C(g)平衡体系,在不同条件下,反应混合物中A、B、C的体积分数和时间t的关系如图4所示:
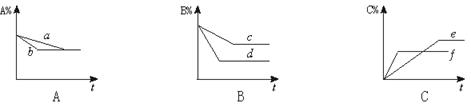
图4
(1)若图A的a和b两条曲线分别表示有无催化剂的情形,曲线 表示有催化剂的情形。
(2)若图B中c、d两条曲线分别表示不同温度的情形,则曲线 表示高温时的情形。
(3)若图C中e、f表示不同压强时的情形,则曲线 表示压强较大时的情形,方程式中A、B两种物质的系数m、n分别为 、 。
22.(8分)铜和硝酸反应的物质的量的关系如图5所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列关系:
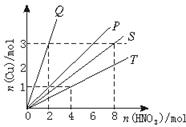
图5
A.Cu和浓HNO3
B.Cu和稀HNO3
C.Cu和被还原的HNO3(浓)
D.Cu和被还原的HNO3(稀)
其中(1)Q表示反应 ;P表示反应 。
(2)写出离子反应方程式:
S
T
23.(7分)图中的每一个方格表示有关的一种反应物或生成物,其中A、C为无色气体。请填下列空白:
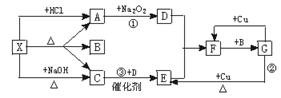
(1)物质X可以是 ,C是 ,F是 。
(2)反应①的化学方程式是 。
(3)反应③的化学方程式是 。
24.(10分)向1 mol/L的NH3·H2O中滴加1 mol/L的盐酸,形成的无色溶液中4种离子浓度按从大到小表示出来,请填写表格中的空格。
| 溶液pH | 离子浓度 | 溶质化学式 |
| 7 | n(NH3·H2O) | |
| =7 | ||
| 7 | NH4Cl | |
| 7 | n(NH4Cl) | |
| 7 | n(NH4Cl)=n(HCl) |
25.(8分)3.2 g Cu与过量硝酸(a mol·L-1,20 mL)充分反应。硝酸的还原产物只有NO2、NO,反应后含H+为0.1 mol。
(1)此时溶液中所含NO![]() 为
mol。
为
mol。
(2)求生成的气体中NO2和NO的物质的量各是多少(用含a的式子表示)。
高三化学全国统一标准测试(三)答案
1.C 2.C 3.B 4.C 5.C 6.D 7.A 8.A 9.A
10.C 11.D 12.B 13.D 14.C 15.D 16.C 17.C 18.B
19.(1)B、F、G (2分)
(2)①浓度 ②温度 ③灯泡功率 ④电路并联 ⑤导线 ⑥溶剂 ⑦极板间距 ⑧电极材料 (任三条给3分)
20.(1)错误的 若溶液不显中性,则H+或OH-被稀释,测出的不为原溶液中H+或
OH-对应的pH
(2)不一定有误差,当溶液为中性时则不产生误差
(3)测得的盐酸的pH误差较大 因为在稀释过程中醋酸继续电离产生H+,使得溶液中c(H+)较盐酸溶液中c(H+)变化小,误差较小 (每空2分,共10分)
21.(1)b (2分) (2)d (2分) (3)f 1 1 (各1分,3分)
22.(1)D C
(2)S:3Cu+2NO![]() +8H+===3Cu2++2NO↑+4H2O
+8H+===3Cu2++2NO↑+4H2O
T:Cu+2NO![]() +4H+===Cu2++2NO2↑+2H2O (各2分)
+4H+===Cu2++2NO2↑+2H2O (各2分)
23.(1)(NH4)2CO3或NH4HCO3 NH3 NO2 (各1分)
(2)2Na2O2+2CO2===2Na2CO3+O2 (2分)
(3)4NH3+5O2![]() 4NO+6H2O (2分)
4NO+6H2O (2分)
24.>7
c(NH![]() )>c(Cl-)>c(OH-)>c(H+)〔或c(NH
)>c(Cl-)>c(OH-)>c(H+)〔或c(NH![]() )>c(OH-)>c(Cl-)>c(H+)〕
)>c(OH-)>c(Cl-)>c(H+)〕
c(NH![]() )=c(Cl-)>c(H+)=c(OH-)
NH3·H2O NH4Cl
)=c(Cl-)>c(H+)=c(OH-)
NH3·H2O NH4Cl
<7
c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
<7
c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
<7
c(Cl-)>c(NH![]() )>c(H+)>c(OH-) (每空1分)
)>c(H+)>c(OH-) (每空1分)
25.(1)0.2 (3分)
(2)解:设NO2 x mol,NO y mol
由电子守恒:x+3y=![]() ×2 ①
×2 ①
由物料守恒:x+y=![]() ×a-0.2 ②
×a-0.2 ②
由①②组合解得:![]() (共5分)
(共5分)