高三化学全国统一标准测试(四)
命题范围:几种常见金属、化学实验方案设计
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
可能用到的相对原子质量:H 1 C 12 Be 9 N 14 O 16 F 19 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Fe 56 Cu 64
第Ⅰ卷
(选择题 共20题 每题2分 共40分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。
3.如果不采用答题卡答题,请把第Ⅰ卷(选择题)的答案填入第Ⅱ卷的选择题答题栏中。
在下列各题的四个选项中,只有一个选项是符合题目要求的。
1.镁粉在焰火、闪光粉中是不可缺少的原料,工业制造镁粉是将蒸气在某气体中冷却,下列可作为冷却气体的是
①空气 ②CO2 ③Ar ④H2 ⑤N2
A.①② B.③④
C.②③ D.④⑤
2.在下列反应中,能置换出铁的是
A.Cu+FeCl3(溶液) B.Na+FeSO4(溶液)
C.Al+Fe3O4(高温) D.Ag+FeSO4(溶液)
3.将含有Mg2+和Al3+的混合液中的Al3+沉淀下来,应采用的试剂是
A.向混合液中加入适量的NaOH溶液
B.向混合液中加入过量的NaOH溶液
C.向混合液中加入氨水
D.向混合液中加入氯化铵后再加入适量氨水
4.当燃烧镁和某金属组成的合金,所形成的氧化物的质量为反应前合金质量的2倍,另一金属可能是
A.铜 B.铍 C.钠 D.铝
5.只用一种试剂,可区别Na2SO4、MgSO4、AlCl3、NH4Cl四种溶液,这种试剂是
A.HCl B.BaCl2 C.AgNO3 D.NaOH
6.对天然水常加入下列物质进行处理:①氯化铝 ②氯化铁 ③石灰和纯碱 ④亚硫酸钠。其中原理和目的都相同的是
A.①③ B.①② C.③④ D.②④
7.将a mol钠和a mol铝一同投入到m g足量水中,所得溶液密度为ρ g/mL,该溶液中溶质的质量分数为
A.![]() % B.
% B.![]() %
%
C.![]() % D.
% D.![]() %
%
8.有Mg、Al、Cu、Ag四种金属的混合物,可以用盐酸把它们分为两组:a、d和b、c。如果在上述加盐酸后的溶液中加足量的NaOH溶液,可得到c离子的沉淀,这四种金属两两组成原电池时,a都是正极。如果用a、b、c、d来表示四种金属的顺序,则下列正确的是
A.Mg、Cu、Al、Ag B.Ag、Al、Mg、Cu
C.Cu、Mg、Al、Ag D.Al、Ag、Mg、Cu
9.某无色溶液中,放入铝片,立即产生大量H2,则下列离子在该溶液中一定可以大量存在的是
A.Na+ B.Fe3+
C.NO![]() D.HCO
D.HCO![]()
10.设计了五种制备气体的方案:①加热稀硫酸和乙醇制备乙烯 ②加热稀盐酸和二氧化锰制备氯气 ③用稀H2SO4和大理石制备CO2 ④用稀硝酸和硫化亚铁制备H2S ⑤用稀H2SO4和食盐共热制备HCl不宜采用的方案
A.只有①和② B.只有②和③
C.只有④和⑤ D.①②③④⑤
11.向某溶液中加入过量盐酸,生成白色沉淀,过滤后向滤液中加入过量氨水使溶液呈碱性,又有白色沉淀生成,再过滤后又向滤液中加入Na2CO3溶液,再次生成白色沉淀,原溶液中含有的离子是
A.Ag+、Al3+、Ba2+ B.Cu2+、Ba2+、Ag+
C.Fe3+、Ca2+、Ba2+ D.Mg2+、Al3+、Ca2+
12.把锌片和铁片放在盛有稀食盐水和酚酞试液的表面皿中,装置如图所示,先观察到变红的区域是
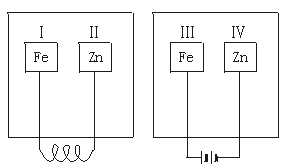
A.Ⅰ和Ⅲ B.Ⅰ和Ⅳ
C.Ⅱ和Ⅲ D.Ⅱ和Ⅳ
13.用一定物质的量浓度的NaOH溶液,使相同体积的FeSO4溶液和Fe2(SO4)3溶液中的Fe2+、Fe3+完全沉淀,如果所用的NaOH溶液的体积相同,FeSO4溶液和Fe2(SO4)3溶液的物质的量浓度之比为
A.1∶1 B.1∶3
C.3∶1 D.3∶2
14.把铝粉和Fe3O4配成铝热剂,并分成两等份,前一份在高温下恰好反应,并将生成物和足量的盐酸充分反应。后一份直接加入足量NaOH溶液使之充分反应,前后两种情况下生成的气体在同温同压下的体积比是
A.1∶1 B.9∶8
C.3∶4 D.4∶3
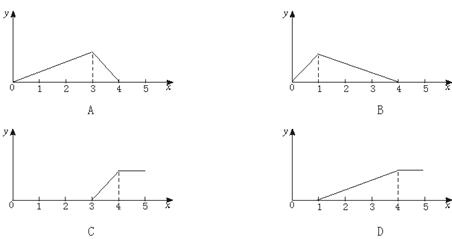
15.在NaOH溶液中加入AlCl3溶液,得到沉淀的量(y)与所加AlCl3溶液的体积(x)的函数图象正确的是
16.向明矾溶液中,滴入Ba(OH)2溶液,当SO2-4沉淀完全时,铝元素的存在形式是
A.一部分为Al(OH)3,一部分为Al3+
B.一部分为Al(OH)3,一部分为AlO![]()
C.全部为Al(OH)3
D.全部为AlO![]()
17.为了除去ZnCl2酸性溶液中的FeCl3,可在搅拌条件下加入一种试剂,使溶液的pH升高,过滤后再向溶液中加入适量的盐酸。这种试剂是
A.KOH B.ZnCO3
C.Zn(NO3)2 D.K2CO3
18.钢铁在锈蚀过程中,下列5种变化可能发生的是
①Fe由+2价转化为+3价 ②O2被还原 ③产生H2 ④Fe(OH)3失水生成Fe2O3·H2O⑤杂质C被氧化除去
A.①② B.③④
C.①②③④ D.①②③④⑤
19.某原电池总反应离子方程式:2Fe3++Fe===3Fe2+,能实现该反应的原电池是
A.正极为C,负极为Fe,电解质溶液FeCl3溶液
B.正极为Fe,负极为C,电解质溶液Fe(NO3)3溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质CuSO4液
20.向混有Fe2O3的铁屑中加入足量的稀H2SO4,直至固体全部溶解。如果测得溶液中不含Fe3+,产生的Fe2+与H2的物质的量之比为4∶1,则原混合物中Fe2O3与Fe的物质的量之比为
A.1∶1 B.1∶2
C.4∶1 D.3∶1
全国统一标准测试
化 学
第Ⅱ卷
(非选择题 共60分)
| 第Ⅰ卷 | 第Ⅱ卷 | ||||||||||
| 题号 | 1至20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 总分 |
| 分数 | |||||||||||
21.(4分)在金、铜、铁、钠、钾、镁、铝几种金属中,属于轻金属的有_________________;导电性能最好的是__________________;硬度最大的是__________________;熔点最高的是_______________;在空气中最稳定的是_______________;最活泼的是_______________;常温时与水能剧烈反应的有____________________________;既能跟酸反应,又能跟碱溶液反应的是______________。
22.(4分)第3周期金属元素A和B,A单质与适量盐酸反应,B单质与适量稀硫酸反应,分别生成V(A) L和V(B) L H2(同温、同压时测定),且V(A)≠V(B),若要确定A、B的化合价,至少需要知道的数据是________________________。
23.(7分)某学生将混有铜粉的氯化铁晶体(FeCl3·6H2O)提纯,以得到纯净的氯化铁晶体,他提出了下列实验步骤:
a.把样品溶解;b.过滤除去铜粉;c.蒸干溶液即得到氯化铁晶体。
(1)以上实验步骤是否可行?_________________,其原因是什么?(要写出有关的化学方程式)。
(2)请拟出合理的实验方案(只写简单步骤):
①________________________,②________________________,③_________________,④________________________,⑤_________________,⑥_________________。
24.(8分)有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO![]() 、SO
、SO![]() 、Cl-、I-、HCO
、Cl-、I-、HCO![]() ,取该溶液实验如下:
,取该溶液实验如下:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| ②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,后在空气中又变成红棕色 |
| ③取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,加AgNO3溶液 | 有白色沉淀生成,且不溶于HNO3 |
| ⑤取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)为进一步确定其他离子,应该补充的实验是_________________。
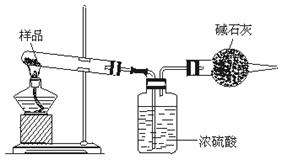
25.(8分)甲、乙两位学生用两种不同方法制取氮气,并测定氮气的相对分子质量(用密度法)。下面是甲、乙两位学生提出的两种制备氮气的实验方案(箭头表示气体的流向)。
甲:空气→碱石灰→红磷(点燃)→水→铜粉(灼热)→集气瓶
乙:NH4NO2(加热)→浓硫酸→镁粉(灼热)→集气瓶(NH4NO2![]() N2↑+2H2O)
N2↑+2H2O)
回答下列问题:
(1)甲、乙两位学生的实验方案是否能制氮气?甲_________、乙_________(填“能”或“不能”)。
(2)具体说明不能制取氮气的原因并纠正(若两种方案都能制氮气,此小题不用回答)_____________________________________。
(3)甲、乙方案中碱石灰和浓H2SO4可否交换位置?说明理由:______________________________________________________________。
(4)甲、乙两位学生按正确装置制取的氮气,用密度法测出相对分子质量(精确到0.001),进行比较:M(甲)_________________M(乙)(填“<”或“=”或“>”)。
26.(7分)砖瓦是含铁元素等杂质的粘土隔绝空气烧制而成的,当烧窑作业临近结束时,若用淋洒水的办法来降低温度,窑内处于还原性气氛,砖块中的铁以氧化亚铁的形式存在,因而砖呈青色。若用捅开窑顶自然冷却的办法,砖就变成了红色。
(1)从化学角度看,砖瓦呈红色的原因是_____________________________________。
(2)现有一块红砖,实验台上有:浓硫酸、3 mol·L-1盐酸、0.1 mol·L-1硫氰化钾溶液、0.1 mol·L-1氯化铁溶液、0.01 mol·L-1氢氧化钠溶液、蒸馏水等试剂,请选用中学化学常用仪器,设计一个实验,用最简捷的方法验证红砖中含有三价铁(简述实验步骤、所用仪器、产生现象、所得结论)。
27.(10分)碱式碳酸镁有多种不同的组成,如Mg2(OH)2CO3、Mg4(OH)2CO3、Mg5(OH)2(CO3)4等。
请你设计一个测定碱式碳酸镁组成的实验方案。包括①测定原理 ②测定实验的装置图 ③操作步骤。
可使用的仪器、试剂和用品如下:
仪器:天平(附砝码)、大试管(附带有短玻璃管的橡皮塞)、酒精灯、洗气瓶、球形干燥管(附带有短玻璃管的橡皮塞)、铁架台、铁夹、角匙。
试剂:碱式碳酸镁(粉状)、浓硫酸、石灰水、无水氯化钙、碱石灰。
其他:火柴、棉花、短橡皮管、弹簧夹。
注意:①上述仪器和试剂只需应用其中的一部分。
②仪器、试剂、用品的数量不限。
28.(6分)已知亚铜离子在酸性条件下能自身氧化还原为Cu2+和Cu,现由氧化铁和氧化亚铜组成的试样,将其等分为X和Y,如图实验:
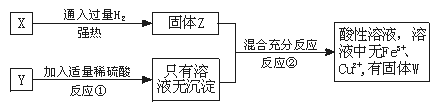
(1)写出①中发生反应的离子方程式_________________。
(2)写出②中发生反应的离子方程式_________________。
(3)原试样中氧化铁和氧化亚铜的物质的量之比为________________________。
29.(6分)工业上从铝土矿(含氧化铝、氧化铁等)制取铝的流程如图所示:
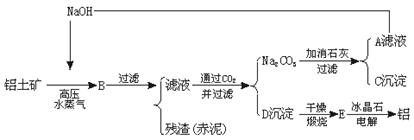
经分析,生产原料(铝土矿)和提取Al2O3后的残渣(赤泥)的部分成分见下表(以氧化物表示)。已知铝土矿中的Fe2O3全部转入赤泥。
| Al2O3 | Fe2O3 | Na2O(由NaOH折算成Na2O) | |
| 铝土矿 | 55% | 16% | 0% |
| 赤泥 | 15% | 48% | 8% |
(1)生产中每消耗1 t铝土矿将产生多少t赤泥?
(2)试计算出每炼1 t铝,理论上需要多少t铝土矿?应补充多少t NaOH?
高三化学全国统一标准测试(四)答案
1.B 2.C 3.D 4.B 5.D 6.B 7.C 8.B 9.A 10.D 11.A 12.B 13.C 14.C 15.C 16.D 17.B 18.C 19.A 20.B
21.(4分)钠、钾、镁、铝 铜 铁 铁 金 钾 钠、钾 铝(每空0.5分)
22.(4分)V(A)∶V(B)的值,n(A)∶n(B)的值(n表示物质的量)(4分)
23.(7分)(1)不可行(1分) 样品加水后发生反应2FeCl3+Cu===2FeCl2+CuCl2,过滤不能除去Cu,滤液中含有FeCl2、CuCl2。蒸干滤液时发生反应 FeCl3+3H2O===Fe(OH)3+3HCl↑,因此得不到纯FeCl3晶体(3分)
(2)①溶解 ②加过量铁粉 ③过滤 ④向溶液中通足量Cl2 ⑤加少量盐酸 ⑥蒸发、浓缩、结晶(3分)
24.(8分)(1)Mg2+、Al3+、NO![]() 、SO
、SO![]() (2分)
(2分)
(2)Fe2+、Ba2+、I-、HCO![]() (2分)
(2分)
(3)焰色反应,取少量原溶液,加入Ba(NO3)2溶液后,取上层清液加入AgNO3溶液和稀HNO3(4分)
25.(8分)(1)能 不能(2分)
(2)因为N2和Mg反应生成Mg3N2,不应通过灼烧镁粉(2分)
(3)不能;甲方案中碱石灰除干燥空气外,还要吸收空气中的CO2,而浓H2SO4只能吸水而不能吸收CO2(2分)
(4)M(甲)>M(乙)(甲气体不纯,有相对分子质量大的稀有气体等存在)(2分)
26.(7分)(1)捅开窑顶,空气进入窑内,铁元素被氧化生成Fe2O3而呈红色(3分)
(2)砸碎红砖,取少量放入研钵内,研成粉末;将粉末放入试管中,向其中加入过量的3 mol·L-1盐酸;振荡,充分反应后静止,向上层清液中滴入几滴KSCN溶液;若呈血红色,则证明有三价铁存在。(4分)
27.(10分)(1)通过测定MgO、CO2、H2O的物质的量之比来测定碱式碳酸镁的组成。(2分)
(2)测定实验的装置如上图所示:(3分)
(3)操作步骤
①将装置按上图连接好后,检查装置的气密性 ②称取一定量(W1 g)样品放入大试管中 ③加热,至样品完全分解④实验结束后,称量洗气瓶和干燥管的增重(设为W2、W3) ⑤计算MgO、CO2、H2O的物质的量之比为
n(MgO)∶n(CO2)∶n(H2O)=![]() ∶
∶![]() ∶
∶![]()
确定碱式碳酸镁的组成。(5分)
28.(6分)(1)Fe2O3+6H+===2Fe3++3H2O Cu2O+2H+===Cu+Cu2++H2O 2Fe3++Cu
===2Fe2++Cu2+(2分)
(2)2Fe3++Fe===3Fe2+ Cu2++Fe===Fe2++Cu(2分)
(3)n(Fe2O3)∶n(Cu2O)≥1∶1(2分)
29.(6分)解:(1)根据制取铝的流程,从铝土矿到赤泥,氧化铁的质量未变。
设赤泥的质量为x,则:x×48%=1 t×16% x=1/3 t(2分)
(2)2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
设需要铝土矿的质量为y,则:(y×55%-y×15%/3)×54/102=1 t
y=3.78 t(2分)
Al2O3+2NaOH===2NaAlO2+H2O 2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
从反应看,与Al2O3反应的NaOH正是以上反应生成的。应补充的是赤泥中的NaOH,为(3.78 t×8%×2×40/62)/3=0.129 t(2分)