高三化学全国统一标准测试(一)
命题范围:化学反应及其能量变化、碱金属、物质的量、卤素
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷两部分。共100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 Na 23 O 16 Al 27 Cl 35.5 Zn 65 I 127
第Ⅰ卷
(选择题 共20题 1~10题每题2分 11~20题每题3分 共50分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。
在下列各题的四个选项中,只有一个选项是最符合题目要求的。
1.18世纪70年代,瑞典化学家舍勒在研究一种白色的盐时,发现在黑暗中此盐并无气味,而在光照时开始变黑并有刺激性气味,此盐是
A.AgF B.AgBr
C.AgCl D.AgI
2.对于1 mol CO2描述正确的是
A.其密度是1.96 g·L-1
B.其摩尔质量是44 g
C.它的体积约为22.4 L
D.所含原子个数是阿伏加德罗常数的3倍
3.某胶体遇盐卤(MgCl2·6H2O)或石膏易发生凝聚,而与食盐水或Na2SO4溶液相遇凝聚的效果就差一些。下列有关说法正确的是
A.该胶体中胶粒直径约10-9~10-7 cm
B.电泳时,该胶粒向阴极方向移动
C.遇BaCl2或Fe(OH)3胶体不发生凝聚
D.Na+使此胶体凝聚的效果不如Ca2+、Mg2+
4.下列保存试剂的方法中,错误的是
A.氢氟酸要保存在塑料瓶中
B.新制氯水要保存在无色细口瓶中
C.液溴要保存在棕色细口瓶中
D.单质碘要保存在棕色广口瓶中
5.容量瓶上需标有①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥碱式或酸式六项中的
A.①③⑤ B.②④⑥
C.③⑤⑥ D.①②③
6.关于铯的性质有以下估计,其中错误的是
A.铯的硬度比钠大 B.铯的熔点比钠低
C.铯遇水时可能发生爆炸 D.铯与硫反应时发生爆炸
7.下列变化能显著放热的是
A.Ba(OH)2·8H2O晶体和NH4Cl晶体的反应
B.Na2O2与H2O的反应
C.灼热的碳与二氧化碳的反应
D.NH4NO3晶体溶于水
8.已知气体的密度与它的摩尔质量成正比。一个气球若放在空气中静止不动,那么在相同条件下该气球放在下列气体中会下沉的是(空气的相对分子质量是29.0)
A.O2 B.Cl2
C.CO2 D.CH4
9.在相同的温度和压强下,将3.2 g硫粉分别于纯氧中和空气中完全燃烧,设放出的热量为Q1和Q2,则关于Q1和Q2的大小判断正确的是
A.Q1=Q2 B.Q1<Q2
C.Q1>Q2 D.无法判断
10.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,其正确的是
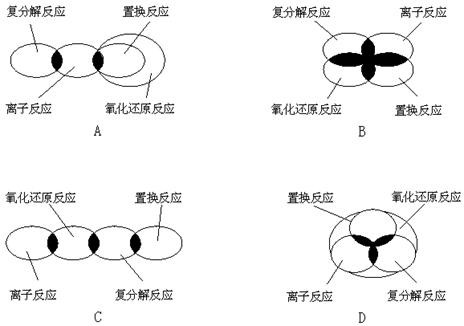
11.下列物质的性质比较,正确的是
A.热稳定性:Na2CO3>NaHCO3>H2CO3
B.熔点:K>Na>Li
C.溶解度:NaHCO3>Na2CO3
D.氧化性:K+>Na+>Li+
12.对于①a g Na2CO3 ②a g Na2CO3和NaHCO3的混合物,下列描述正确的是
A.分别配成等体积的溶液,②的pH大
B.分别与盐酸反应时,②耗酸量大
C.分别与足量盐酸反应,②放出CO2多
D.分别配成等体积的溶液,②中Na+浓度大
13.向CaCl2、MgBr2、KI的混合溶液中通入Cl2后,若溶液中存有Br2,则一定不会有
A.I- B.Cl2
C.Br- D.Cl-
14.某温度下,将Cl2通入KOH溶液中,反应中得到KCl、KClO、KClO3的混合物,经测定c(ClO-)∶c(ClO![]() )=1∶3,则此反应中被还原氯元素与被氧化氯元素的质量比为
)=1∶3,则此反应中被还原氯元素与被氧化氯元素的质量比为
A.21∶5 B.11∶3
C.3∶1 D.4∶1
15.下列离子方程式正确的是
A.Fe与稀硫酸反应 2Fe+6H+===2Fe3++3H2↑
B.氯气通入水中 Cl2+H2O===2H++Cl-+ClO-
C.酸性硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+===Fe3++4H2O
D.碳酸钙与醋酸溶液反应CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O
16.已知0.6 mol SO![]() 恰能被0.2 mol X2O
恰能被0.2 mol X2O![]() 氧化,那么还原产物中X元素的化合价为
氧化,那么还原产物中X元素的化合价为
A.+3 B.-3
C.+2 D.+4
17.用NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol Na作还原剂可提供的电子数为NA
B.16 g氧气中所含氧分子数为NA
C.在标准状况下,22.4 L辛烷中所含分子数为NA
D.18 g重水(D2O)所含电子数为10NA
18.已知2H2O(l)===2H2(g)+O2(g);ΔH=+517.6 kJ·mol-1 CH4(g)+2O2(g)===2H2O(l)+CO2(g);ΔH=-890.3 kJ·mol-1,将1 g H2和1 g CH4分别完全燃烧,放出热量之比为
A.1∶3.4 B.1∶1.7
C.2.3∶1 D.4.6∶1
19.已知在酸性溶液中,下列各物质氧化I-时,自身发生如下变化:Fe3+![]() Fe2+,MnO
Fe2+,MnO![]()
![]() Mn2+,Cl2
Mn2+,Cl2![]() Cl-,HNO2
Cl-,HNO2![]() NO。若用这些物质分别与KI作用且得等质量的I2,需用物质的量最少的是
NO。若用这些物质分别与KI作用且得等质量的I2,需用物质的量最少的是
A.Fe3+ B.MnO![]()
C.Cl2 D.HNO2
20.某金属M的氯化物的溶液20 mL,物质的量浓度为0.05 mol·L-1,恰好与20 mL 0.15 mol·L-1 AgNO3溶液反应,则该氯化物的化学式为
A.MCl4 B.MCl3
C.MCl2 D.MCl
)
全国统一标准测试
化 学
第Ⅱ卷
(非选择题 共8题 共50分)
| 题号 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 总分 |
| 分数 |
21.(6分)下图所示支管中,左管中放入KMnO4固体,右管中放入一小块钠,再向两管均加入适量8 mol·L-1的盐酸,半分钟后,盖以橡胶塞并对此支管固定在铁架台上。用一照像机对准此支管,按快门,闪光灯闪亮。请回答:
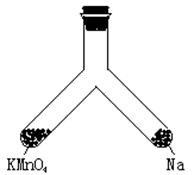
(1)“照像”之前,左管中反应的离子方程式_______________________,右管中离子方程式为_____________________。
(2)“照像”时,灯光闪亮,支管随之出现现象____________________,化学方程式为____________________。
22.(8分)实验室需将18 mol·L-1的浓硫酸稀释成3 mol·L-1的稀硫酸100 mL。请将此实验各步操作补充完整。
(1)量取浓硫酸。将______________________中的浓硫酸慢慢沿烧杯壁注入盛有适量蒸馏水的小烧杯中,并不断用玻璃棒搅拌,共需注入烧杯中浓硫酸______________mL。
(2)__________________________________
(3)用蒸馏水洗涤小烧杯及玻璃棒,____________________,重复此操作两次。
(4)__________________________________
23.(5分)当把湿润的淀粉碘化钾试纸放在氯气中,试纸变蓝,用离子方程式来表示变蓝的原因:_____________________。过一段时间又变为无色,这步变化的原因是:在水溶液中氯单质可以把碘单质氧化成IO![]() ,反应方程式为:
,反应方程式为:
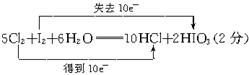
5Cl2+I2+6H2O===10HCl+2HIO3
在此化学方程式上标出电子转移方向和数目(用双线桥法),在此反应中每消耗1 mol氯气可氧化______________g I2。
24.(6分)多原子分子氰(CN)2和氧氰(OCN)2的性质与卤素单质相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| 卤素 | 氰 | 硫氰 | 氧氰 | |
| “单质” | X2 | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | ① | ② | HOCN |
| 盐 | KX | KCN | KSCN | ③ |
(1)在表中①、②、③空格处应分别填写__________、__________、__________。
(2)完成下列反应的化学方程式:
①MnO2与浓HSCN共热:___________________;
②(CN)2与水反应:______________________________。
25.(6分)下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
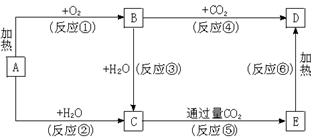
请填写下列空白:
(1)写出化学式:A________________,B________________,D________________。
(2)以上反应中,属于氧化还原反应的有____________________(填写编号)。
(3)写出E→D的化学方程式。
26.(5分)有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的产物已经略去。
![]()
(1)若A与NaOH反应,既可只生成B,又可只生成C,还可生成B+C,写出符合上述反应关系的A的两种不同类物质的分子式:___________________、___________________。
(2)若A与NaOH无论以何种物质的量比反应,其产物必为B+C,则A的分子式可能是____________(只写一种),R在A、B、C中的化合价必须满足的条件是_________________。
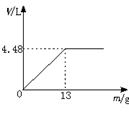
27.(6分)现将600 mL稀硫酸等体积分为6份,并向其中5份中分别加入质量不等的Zn粒,并收集生成的氢气,有以下记录结果(H2 体积已折算为标准状况)。
| 实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
| Zn粒质量(g) | 5.0 | 8.0 | 12 | 14 | 16 |
| H2体积(L) | 1.72 | 4.14 | 4.48 | 4.48 |
(1)由实验结果可推知,此稀硫酸的物质的量浓度为____________________。
实验②收集到H2的体积为____________________。
(2)若向第6份稀硫酸中不断加入Zn粒,请在下图中画出H2体积(V)与Zn粒质量(m)的关系图象。
28.(8分)将1.05 g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加入50 mL 1 mol·L-1的盐酸,恰好使反应过程中产生的沉淀刚好消失。求原混合物中含铝、过氧化钠各多少克?
高三化学全国统一标准测试(一)答案
1.C 2.D 3.D 4.B 5.A 6.A 7.B 8.D 9.B 10.A 11.A 12.C 13.A 14.D 15.D 16.A 17.A 18.C 19.B 20.B
21.(6分)(1)2MnO![]() +16H++10Cl-===2Mn2++8H2O+5Cl2↑(1分)
+16H++10Cl-===2Mn2++8H2O+5Cl2↑(1分)
2Na+2H+===2Na++H2↑(1分)
(2)支管内气体发生爆炸,胶塞被冲出支管口;(2分)
H2+Cl2![]() 2HCl(2分)
2HCl(2分)
22.(8分)(1)酸式滴定管 16.67(2分)
(2)将已冷却至室温的硫酸溶液沿玻璃棒注入100 mL容量瓶中。(2分)
(3)洗涤液一并转入容量瓶中(1分)
(4)继续向容量瓶中加蒸馏水,直到液面离刻度线1~2 cm处,再用胶头滴管加水,使溶液凹液面恰与刻度相切,盖紧瓶塞,摇匀。(3分)
23.(5分)2I-+Cl2===2Cl-+I2(2分)
 |
50.8(1分)
24.(6分)(1)HCN HSCN KOCN(2分)
(2)①MnO2+4HSCN(浓)![]() Mn(SCN)2+(SCN)2↑+2H2O(2分)
Mn(SCN)2+(SCN)2↑+2H2O(2分)
②(CN)2+H2O===HCN+HCNO(2分)
25.(6分)(1)Na Na2O2 Na2CO3(2分)
(2)①②③④(2分)
(3)2NaHCO3![]() Na2CO3+CO2↑+H2O(2分)
Na2CO3+CO2↑+H2O(2分)
26.(5分)(1)CO2、H2S、AlCl3等(2分)
(2)Cl2 A中R元素化合价介于B、C中R元素化合价之间(3分)
27.(6分)(1)2.0 mol·L-1 2.76 L(4分)
 |
(2) (2分)
28.(8分)解:设原混合物中铝的物质的量为x,Na2O2物质的量为y,
则有
![]()
得x=y=0.01 mol
有铝的质量:0.01 mol×27 g·mol-1=0.27 g
过氧化钠质量:0.01 mol×78 g·mol-1=0.78 g
答:(略)