高三化学实验综合练习(三)
可能用到的相对原子质量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12 Ca: 40
一、选择题(下列各题只有1个选项符合题意。每小题2分,共12分。)
1.用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为 x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为
A.量筒 B.容量瓶 C.滴定管 D.以上均不对
2.配制一定物质的量浓度的NaOH溶液时,造成所配溶液的浓度偏高的是
A.所用NaOH固体已潮解
B.在需用游码的托盘天平上称量NaOH固体时,砝码与固体的位置放颠倒
C.在天平的托盘上各放一张纸,将NaOH固体放在左盘的纸上称量
D.定容时,俯视液面达容量瓶的刻度线
3.下列药品存放方法中错误的是
A.少量白磷存放在水里 B.少量金属钠存放在煤油里
C.浓硝酸存放在棕色瓶里,且置于冷暗处D.氢氧化钠存放带玻璃塞的试剂瓶中
4.在实验过程中,为防止下列情况发生,采取的措施错误的是
A.制取蒸馏水时,为防止烧瓶内产生暴沸,应事先向烧瓶中加入几片碎瓷片
B.在用系列实验装置制取和检验Cl2的实验时,尾气会污染空气,应用水吸收尾气
C.用加热KMnO4法所制得的氧气会略带紫色,应在靠近试管口的地方放一团棉花
 D.用电石制乙炔,产生气体的速率过快,应逐滴滴入饱和食盐水
D.用电石制乙炔,产生气体的速率过快,应逐滴滴入饱和食盐水
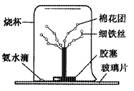
5.某研究性学习小组设计了如右图所示的实验装置。取4条长15 cm的细铁丝,下端拧在一起,插在胶塞上,放在玻璃片上,上端分开成树形,将浸有酚酞试液的棉花团绑在树枝上制成“花树”,在玻璃片上滴一滴浓氨水,罩上大烧杯。有关该试验的说法正确的是
①过一会儿,棉花团由白色变成红色,犹如一株开满红色花朵的“铁树”;②氨水能使酚酞变红;③氨水中存在电离平衡,是一种弱碱;④氨水具有挥发性;⑤分子在不停地运动。
A.①②③④ B.①②④⑤ C.①②③④⑤ D.②③④⑤
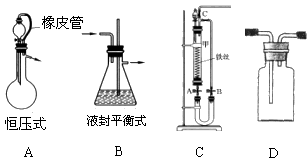
6.气体制备过程中,因装置堵塞或气体产生速率太快而造成单位体积内气体分子数增多,内压增大造成危险。下图是某同学设计的几种装置,其中不能用来防堵塞的是
7.可用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是
A.氯化铁溶液、溴水 B.碳酸钠溶液、溴水
C.酸性高锰酸钾溶液、溴水 D.酸性高锰酸钾溶液、氯化铁溶液
8.下列除去杂质的方法正确的是
A 除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B 除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
D 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成份是
A.CH4和NH3 B.HCl、H2和CO C.HCl和CO D.HCl、CO和CO2
10.下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是 ①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用洒精中
A.②③①④ B.③②①④ C.③①②④ D.①②③④
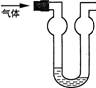 11.双球洗气管是一种多用途仪器,常用于去除杂质、气体干燥、气体吸收(能防止倒吸)等实验操作.右图是用水吸收下列某气体时的情形,根据下面附表判断由左方进入的被吸收气体是
11.双球洗气管是一种多用途仪器,常用于去除杂质、气体干燥、气体吸收(能防止倒吸)等实验操作.右图是用水吸收下列某气体时的情形,根据下面附表判断由左方进入的被吸收气体是
A.Cl2 B.HCl C.H2S D.CO2
附:四种气体的溶解度表(室温下)。
| 气体 | Cl2 | HCl | H2S | CO2 |
| l体积水约能吸收气体体积数 | 2 | 500 | 2.6 | 1 |
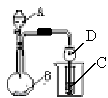 12.如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是
12.如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是
A.若A为醋酸,B为贝壳,C中盛Ca(OH)2溶液,则C中出现混浊
B.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中有白色沉淀
D.实验仪器D可起到防止倒吸的作用
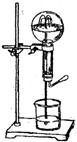 喷泉是一种常见的自然现象,其产生原因是存在压强差。请回答13、14小题。
喷泉是一种常见的自然现象,其产生原因是存在压强差。请回答13、14小题。
13.右图为化学教学中用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是
A.HCl和H2O B.O2和H2O
C.NH3和H2O D.CO2和NaOH溶液
14.某学生积极思考产生喷泉的其他办法,并设计了如右图所示的装置。
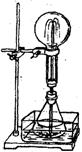 在右下图的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
在右下图的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
15.在右下图锥形瓶外一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。
水槽中加入的物质可以是
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜
16.在烧杯中加入水和苯(密度:0.88g/cm3)各50mL。将一小粒金属钠(密度:0.97g/cm3)投入烧杯中。观察到的现象可能是
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并可能作上、下跳动
17.在有乙离子存在的情况下,欲用试剂丙来检验溶液中是否含有甲离子,下表所加试剂丙能够对甲离子进行成功检验的是:(说明:在实验过程中不允许加热、过滤、萃取等操作)
| 选项 | 试剂丙 | 甲离子 | 乙离子 |
| A | 稀盐酸、Ba(NO3)2溶液 | SO42- | SO32- |
| B | AgNO3溶液 | Cl- | I- |
| C | KSCN溶液 | Fe2+ | Fe3+ |
| D | 稀氨水 | Al3+ | Ag+ |
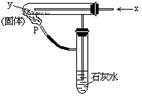 18.按右图装置持续通入x气体,并在管口P处点燃,实验结果使澄清的石灰水变浑浊.则x、y不可能是
18.按右图装置持续通入x气体,并在管口P处点燃,实验结果使澄清的石灰水变浑浊.则x、y不可能是
A.CO和CuO B.CO和NaHCO3
C.H2和NaHCO3 D.H2和Fe2O3
三、实验设计与评价(23分)
19.(8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是:
Mg(OH)2(s) ![]() Mg2++2OH--------------------------------------①
Mg2++2OH--------------------------------------①
NH4++H2O![]() NH3·H2O+ H+------------------------------------②
NH3·H2O+ H+------------------------------------②
H++ OH-![]() H2O---------------------------------------------------③
H2O---------------------------------------------------③
由于NH4+水解显酸性,H+与Mg(OH)2反应生成水,导致反应①平衡右移,沉淀溶解;乙同学解释是:
Mg(OH)2(s) ![]() Mg2++2OH--------------------------------------①
Mg2++2OH--------------------------------------①
NH4++ OH-![]() NH3·H2O----------------------------------------②
NH3·H2O----------------------------------------②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是_______________________(填写编号)。
A.Mg(OH)2 B.CH3COO NH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由
_____________________________________________________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理____________________(填“甲”或“乙”);完成NH4Cl饱和溶
液使Mg(OH)2悬浊液溶解的离子方程式___ ________ ________________。
20.(8分)某校化学课外活动小组对实验室两瓶失去标签的白色固体Na2SO4和NH4Cl进行鉴别,经讨论可行的实验方案有多种,请你设计四种实验方案加以鉴别。简要写出操作过程、现象和结论。
| 方案 | 操作过程 | 现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
21.(7分)某研究性学习小组在研究塑料的降解时做了如下实验。装置如图:
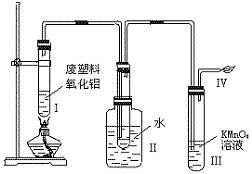
(1)写出你所知道的生成乙烯的化学方程式 。
(2)Ⅲ中的现象是 ,Ⅳ中的反应方程式是 。
据此现象提出你在治理白色污染方面的设想:
。
三、推断题(9分)
22.下图A—J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A—E和F—J中分别含有同一种元素。反应E→A+O2的条件未标出。
|
![]()
|
![]()
![]() A D E——
A D E——
![]()
|
|
| |||||
![]()
![]() J ←————I ←——H←——G F
J ←————I ←——H←——G F
请填写下列空白:
(1)化合物H中的阳离子_______;D的化学式___________。
(2)A生成B反应的离子方程式是______________________________________。
(3)A和F的混合物叫做___________,发生反应的化学方程式是
_________________________________________________________________。
(4)I→J反应的化学方程式是___________________________________________。
该反应过程中发生的现象是_________________________________________。
四、综合实验(22分)
23.(10分)氯磺酸(HSO3CI)是无色液体,密度为1.79g·cm-3,其沸点约152℃;氯磺酸有强腐蚀性,遇潮湿空气生成浓烈的白雾,它属于危险品。制取氯磺酸是在常温下将干燥的氯化氢气体通入溶有三氧化硫的硫酸(发烟硫酸)中,氯化氢与三氧化硫化合即得氯磺酸。在实验室里制取氯磺酸可用下图所示的装置(图中衬垫、夹持和固定仪器均已略去)。
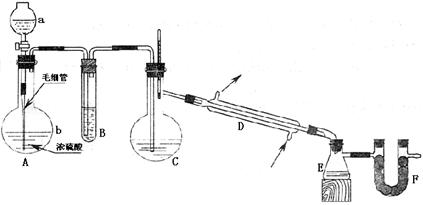
所用到的试剂有:①密度为1.19g·cm-3的浓盐酸; ②密度为1.84g·cm-3质量分数为98.3%的浓硫酸(98.3%的浓硫酸沸点是338℃); ③发烟硫酸; ④无水氯化钙 ⑤水;⑥碱石灰。试填空:
(1)对应仪器中应盛入的试剂或药品(填序号):
A中的a为 ;B中为 ,C 中为 。
(2)A中的分液漏斗下端接有的毛细管的作用是 ;将毛细管插入液面并接近烧瓶底部这是为了 ;若不用毛细管直接用分液漏斗注入 a中液体,可能发生的现象是 。
(3)写出实验室制备氯磺酸的化学方程式 ;反应到一定程度时需用酒精灯在C装置下加热的作用是: 。
(4)F装置中加入的试剂是 (填序号,限在本题给定的试剂中选择),其作用是 .
24.(12分)某研究性学习小组设计了下面三种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
 (1)在试管Ⅰ里加入的试剂是
。
(1)在试管Ⅰ里加入的试剂是
。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
方法三:应用右图所示的电解实验可以制得白色的纯净的
Fe(OH)2沉淀。两电极材料分别为石墨和铁.
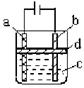 (1)a电极材料应为 ,电极反应式为
。
(1)a电极材料应为 ,电极反应式为
。
(2)电解液C可以(填编号)是 。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是 ,在加入苯之前对C应作何简单处理 。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号) 。
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减小两电极间的距离 D.适当降低电解液的温度
(5)若C中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一现象是 。