高三化学试题3
第I卷(选择题,共72分)
原子量:H:1 C:12 O:16 S:32 Cl:35.5 Na:23 Mg:24 Al:27
Cu:64 Ba:137
一、选择题(每小题4分,共32分。每小题只有一个选项符合题意)
1、有人认为在元素周期表中,位于IA族的氢元素,也可以放在VIIA族,下列物质能支持这种观点的是:
A、HF B、H3O+ C、NaH D、H2O2
2、锌与100mL 1mol / L盐酸反应的实验中,若设想向溶液中加入少量的①醋酸钠,或②溴化铜,或③醋酸铜(均为可溶性),并测定生成氢气的速率(mL / min),预计三种方案的速率大小是( )
A、①>③>② B、③>②>① C、②>③>① D、①>②>③
3、某卤素X2与热的浓NaOH溶液反应生成A、B两种盐,向A盐溶液中加入一定量另一种卤素Y2的水溶液,又可生成X2,且X2不能使淀粉变蓝,则X2、Y2分别是:
A、I2、Cl2 B、Cl2、Br2 C、Br2、Cl2 D、Cl2、F2
4、在一定条件下,合成氨反应达到平衡后,混合气体中NH3的体积分数为25%。若反应前后条件保持不变,则反应后缩小的气体体积与原反应物总体积的比值是:
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
5、将SO2通入下列试剂中能产生沉淀的是①氯化钡溶液 ②盐酸酸化的氯化钡
③硝酸酸化的氯化钡 ④溶解了氨气的氯化钡溶液。![]()
A、①②③④ B、②③④ C、③④ D、①③
6、下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是:
A、SO2和SiO2 B、CO2和H2O
C、NaCl和HCl D、CCl4和KCl
7、用石墨作电极,电解1mol / L下列物质的溶液,溶液的pH保持不变的是:
A、CuSO4 B、NaOH C、NaCl D、Na2SO4
8、关于胶体的叙述中不正确的是:
A、利用电泳现象不一定能区别溶液和胶体
B、胶体都能发生丁达尔现象
C、胶体粒子的大小都在1nm-100nm之间
D、Fe (OH)3胶体在外加电场中向阴极移动
二、选择题(每小题4分,共40分。每小题有1-2个选项符合题意)
9、用NA代表阿伏加德罗常数,下列叙述正确的是:
A、镀铜时阳极消耗6.4kg,则有2×102 NA个电子转移
B、100ml 0.1mol/L的Na2CO3溶液中,CO32-数目为0.01NA
C、将NA 个NO2分子降温至标准标准状况,其体积为22.4L
![]() D、原子反应堆用的重水18g,含有10NA个电子
D、原子反应堆用的重水18g,含有10NA个电子
10、对于反应2SO2 + O2 2SO3,下列判断正确的是:
A、2体积SO2和足量O2混和反应,必定生成2体积SO3
B、其它条件不变,增大压强,平衡必定向右移动
C、平衡时,SO2消耗速率必定等于O2生成速率的2倍
D、平衡时,SO2浓度必定等于O2浓度的2倍
11、为了使Na2S溶液中C(Na+) / C(S2-)的比值变小,可加入的物质是:
A、适量盐酸 B、适量NaOH溶液
C、适量KOH溶液 D、适量KHS溶液
12、常温下,10ml PH=10的KOH溶液中,加入PH = 4的一元酸HA溶液至PH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是:
A、C(A-)< C(K+) B、C(H+) = C(OH-) < C(K+) < C(A-)
C、V总≥20ml D、V总≤20ml
13、下列关于铜电极的叙述正确的是:
A、铜-锌原电池中铜是正极
B、用电解法精炼铜时,粗铜作阴极
C、在镀件上电镀铜时,可用金属铜作阳极
D、电解稀硫酸制H2、O2时,用铜作阳极
14、A、B为短周期元素,二者能形成化合物AB2。已知A的原子序数为n,B的原子序数为①n+2、②n+5、③n+10、④n+13、⑤n-3、⑥n-6、⑦n-8、⑧n+1,其中
A、①②⑤不可能 B、④⑥不可能
C、⑤⑥不可能 D、①~⑧都可能
15、烧杯中盛放浓度均为0.10mol / L的氯化钠和硝酸铜的混合液。现将该溶液以惰性电极进行电解,当Cu2+全部在阴极上转变为金属铜时,整个溶液(摇匀)的pH为:(lg2=0.3)
A、0.70 B、1.00 C、1.30 D、7.00
16、无色X溶液与铝反应能放出氢气,下列离子组一定不能在原X溶液大量共存的是:
A、Mg2+、Na+、Cl-、NO3- B、Na+、K+、S2-、SO32-
C、NH4+、Mg2+、SO42-、Cl- D、NH4+、Na+、HSO3-、Br-
![]() 17、下列离子方程式正确的是:
17、下列离子方程式正确的是:
![]() A、纯碱与水反应:CO32-+2H2O H2CO3+2OH-
A、纯碱与水反应:CO32-+2H2O H2CO3+2OH-
B、用惰性电极电解氯化镁溶液: 2Cl- +2H2O Cl2↑+ H2↑+2OH-
C、硫酸亚铁溶液中加过氧化氢溶液:Fe2+ + 2H2O2 + 4H+ = Fe3+ + 4H2O
D、氨水与少量的二氧化硫反应:2NH3·H2O + SO2 = 2NH4+ + SO32-+H2O
18、锌粉、铝粉、镁粉的混合物ag,与质量分数为25%的稀硫酸恰好反应完全,蒸发水分后得固体X(不含结晶水)bg,则反应生成的氢气质量为:
A、![]() B、
B、![]()
C、![]() D、无法计算
D、无法计算
第II卷(非选择题,共78分)
三、(本题包括3小题,共23分)
19、(7分)(1)过氧化氢(H2O2)可作为采矿业废液消毒剂,如要消除采矿业废液中的氰化物(其中氮元素为-3价),化学反应式(已配平)为:KCN+H2O2+H2O== A + NH3↑
①生成物A 化学式为__________。
②反应中被氧化的元素为___________。
(2)人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生下列反应,请完成该反应的离子方程式: O2- + H2O == H2O2 + O2+ 。
20、(8分)电子表和电子计算器的电池常用微型银-锌原电池,其电极分别为Zn和Ag2O,电解质溶液为KOH溶液,负极反应和总反应分别为:
Zn + 2OH――2e-= ZnO + H2O和Ag2O + Zn = 2Ag + ZnO
(1)该原电池工作时,负极区溶液的pH_______ (填“上升”、“下降”或“不变”)
(2)该原电池工作时,电子由__________(填“Zn”或“Ag2O”)极经外电路流向________(填“正”或“负”)极,正极上发生的电极反应式为__________________________。
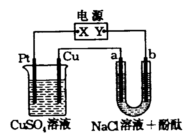 21、(8分)图1所示装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色。
21、(8分)图1所示装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色。
(1)Y为电源的_________极;
(2)写出U型管中的电极反应式:
a_______________________;
b_______________________;
(3)原烧杯中CuSO4溶液是不饱
和的,在通电过程中,CuSO4
溶液的pH_______(填“变大”、“不变”或“变小”)
四、(本题包括2小题,共18分)
22、(6分)下面a~e 是中学化学实验中常见的几种定量仪器:
a、量筒 b、容量瓶 c、滴定管 d、托盘天平 e、温度计
(1)其中标出仪器使用温度的是___________(填写编号)。
(2)能够用以精确量取液体体积的是____________(填写编号)。
(3)由于错误操作,使得到数据比正确数据偏小的是_____(从下列A、B、C中选)。
A、用量筒最取一定量液体时,俯视液面读数
B、中和滴定达终点时俯视滴定管的液面读数
C、使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
23、(12分)图2是实验室制取Cl2并以Cl2为原料进行特定反应的实验。
(1)A为氯气发生装置,写出反应的化学方程式:_________。
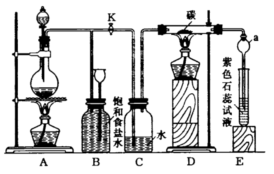 |
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D。D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g)。试写出D装置中反应的化学方程式:__________;装置C的作用是_________。
(3)E处石蕊试液中的现象是________,其原因是________,干燥管a的作用是______。
(4)若将E处溶液改为石灰水,反应过程的现象是_________(填序号)。
A、有白色沉淀生成 B、无白色沉淀生成
C、先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是_________,B的作用是_________。
五、(本题包括2小题,共20分)
24、(8分)A、B、C、D均为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1∶1和2∶1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X, B与C能形成一种极易溶于水的酸性气体Y 。X分子与B2A分子中的电子数相同,Y分子中的电子数为18,A、B和D可形成离子化合物,其化学式为B4A3D2,其水溶液呈弱酸性。请回答:
(1)元素符号:C_________,D__________。
(2)B4A3D2的化学式___________,其水溶液呈现酸性的离子方程式________。
(3)写出化学方程式:C2和X(过量)反应__________。
(4)液态X能电离(可根据B2A电离推知),其阴离子电子式________。
| B E F | |
| 起始组成n / mol | 2 4 0 |
| 某时刻组成 n / mol | 1 2 2 |
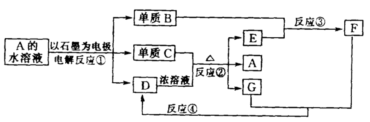
25、(12分)下图中每一方框内的字母代表一种反应物或生成物。
从A到F均为中学化学常见的物质,其中B跟E反应生成物质F,某温度下该反应起始和某时刻的反应混合物组成如右表所示。请写出下列反应的化学方程式:反应①_______ _____;反应②__ _____ _______;反应③(须注明反应条件)___ ___________;反应④_________ ___ ___。
六、(本题包括1小题,共8分)
26、常温、常压下,A、B、C、D均为气态。A与B可发生可逆反应:A + B ![]() C + nD。若将2mol
A和2mol B混合充入容积可变的密闭容器中,在不同条件下达平等时,C的浓度如下:
C + nD。若将2mol
A和2mol B混合充入容积可变的密闭容器中,在不同条件下达平等时,C的浓度如下:
| 温度 / ℃ | 压强 / Pa | C平衡浓度 / (mol·L-1) |
| 25 | 1×105 | 1.0 |
| 25 | 2×105 | 1.8 |
| 25 | 4×105 | 3.2 |
| 25 | 5×105 | 6.0 |
(1)可逆反应中,化学计量数n取值范围为_____________,理由是______________。
(2)在 5×105Pa时,D的状态为_________________,理由是________________。
七、(本题包括1小题,共9分)
27、(9分)1.95g Na2SO4和Na2CO3的混合物溶于水得溶液A,在A中加入足量未知浓度的BaCl2溶液10.0mL,然后过滤得沉淀B和滤液C;在C中加足量的AgNO3溶液,又生成5.74g沉淀;向B中加足量稀硫酸,沉淀不消失反而增加0.18g,计算:
(1)氯化钡溶液的物质的量浓度。
(2)原混合物中硫酸钠的质量分数。
高三化学试题
班别___________ 学号___________ 姓名_____________ 评分_____________
一、二选择题答题表(1-18题)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答 案 | |||||||||
| 题 号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答 案 |
三、19、⑴①_______,②______;⑵ O2-+ H2O == H2O2 + O2+ 。
20、⑴_________ ,⑵_______、_________,_________ __ __________________。
21、⑴________,⑵a:_____________________,b:_____________________。⑶_______。
四、22、⑴______________,⑵______________,⑶______________。
23、⑴_________________________________________________________。
⑵_________________________________________,________ __________。
⑶____________________________________,______________________________
__________________________ __________,_________________ __ __________。⑷_________________。
⑸_______________________ ___________,______________ ________________。
五、24、⑴C_______________、D_______________。
⑵_________________,_____________________________________________。
⑶________________________________________________________________。
⑷_____________________。
25、①______________________________,②______________________________,
③______________________________,④______________________________。
六、26、⑴_______________,________________________________________________
_____________________ ___________ __________________________
,⑵_______ ________。
七、27、解:![]()
高三化学答案
一、二选择题答题表(1-18题)
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答 案 | C | C | C | A | C | B | D | D | A |
| 题 号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答 案 | BC | CD | D | AC | D | B | AD | D | C |
三、19、⑴①KHCO3,②碳;⑵ 2 O2-+ 2 H2O == 1 H2O2 + 1 O2+ 2 OH- (3分)。
20、⑴下降,⑵Zn、正,Ag2O+H2O+2e-=2Ag + 2OH-(每空2分)
21、⑴正,⑵a:2H+ +2e-=H2↑,b:2Cl――2e-=Cl2↑ ⑶不变(每空2分)
四、22、⑴a、b、c ,⑵ c ,⑶ B 。(每空2分)
23、⑴MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
⑵2Cl2 + C + 2H2O![]() 4HCl + CO2 ,提供D处所需要的水蒸气
4HCl + CO2 ,提供D处所需要的水蒸气
⑶石蕊试液先变红,后变成无色,生成的HCl使石蕊试液变红,未反应完的Cl2
与水作用生成HClO,HClO的漂白作用使红色消失,防止E中溶液倒吸至装置D中。
⑷ B。⑸瓶中液面下降,长颈漏斗内液面上升,贮存少量Cl2,避免Cl2污染环境。
五、24、⑴ C:Cl D:N。 ⑵ H4O3N2,NH4+ + H2O![]() NH3
· H2O + H+
NH3
· H2O + H+
⑶2NH3 + 3Cl2 = N2 + 6HCl 、NH3 + HCl = NH4Cl或8NH3+3Cl2=N2+6NH4Cl
![]() ⑷
⑷
![]() 25、① 2CuSO4+2H2O 2Cu+O2↑+2H2SO4
25、① 2CuSO4+2H2O 2Cu+O2↑+2H2SO4
②Cu+2H2SO4(浓) ![]() CuSO4+
SO2↑+ 2H2O
CuSO4+
SO2↑+ 2H2O
![]() ③ 2SO2 + O2 2SO3
④ SO3 + H2O
= H2SO4
③ 2SO2 + O2 2SO3
④ SO3 + H2O
= H2SO4
26、⑴n > 1,当压强增加到2倍,C的浓度只增加到1.8倍,说明增大压强时平衡向左移动,即反应正向是体积增大的反应,故n>1。 ⑵液态或固态,压强由时,C的浓度增至6倍,说明增压平衡向右移动,故在时,A、B、C必为气体,D为固态或液态。
27、解:(1)反应生成沉淀n (AgCl) = ![]()
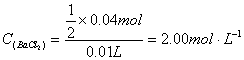
(2)沉淀质量增加是BaCO3转化为BaSO4,设BaCO3物质的量为x。
![]()
![]()
![]()
![]() ∴
∴ ![]()
![]()
答:略。