高三化学第一学期期中考试试题
(答案请写在答题纸上)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 I 127
Na 23 Mg 24 Al 27 Fe 56 Cu 64 Zn 65
一、选择题(每小题只有一个选项符合题意)
1.下列材料的特性及用途的说法中不正确的是
A.光导纤维传导光的能力很强,是非常好的通讯材料
B.氮化铝陶瓷具有两性,不可以用于制造耐高温设备
C.氮化硅陶瓷耐高温且不易传热,可用来制造轴承
D.人造刚玉硬度高,可用来制造刚玉球磨机
2.白云母是重要的无机硅酸盐材料,它的主要成分为K2Al6Si6(OH)nO18,则n为
A.4 B.6 C.8 D.10
3.在NH3、HNO3、H2SO4的工业生产中,具有的共同点是
A.使用吸收塔设备 B.使用尾气吸收装置
C.使用H2作原料 D.使用催化剂
4.在实验室中不宜长期保存的是①氯水 ②银氨溶液 ③食盐水 ④FeSO4溶液⑤Na2SO4溶液
A.①②④ B.②④ C.①②③ D.①②④⑤
5.下列物质间发生化学反应:①H2S+O2 ②Na+O2 ③C2H5OH+O2 ④AlCl3+NaOH ⑤Zn+HNO3 ⑥P2O5+H2O ⑦NH3+O2 ⑧Fe+Cl2 在不同条件下能得到不同产物的是
A.除⑧外 B.除⑤和⑧外 C.除③⑦⑧外 D.全部
6.航天器的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉氧化放热引发高氯酸铵反应,其反应式可表示为:2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑(反应热ΔH<0);下列对该反应的叙述中错误的是
A.NH4ClO4既是氧化剂又是还原剂
B.1molNH4ClO4完全反应时,转移电子14mol
C.反应中只有氯元素被还原
D.从能量角度看,化学能主要转变为热能和动能
7.有FeSO4、Fe2(SO4)3、CuSO4的混合溶液600mL,其中C(SO42-)=0.1mol·L-1,投入一些锌粉,反应后得到的固体沉淀中经测定含有Cu、Fe,但不含Zn,溶液中含有0.01molFe2+。据此可知投入的锌粉的质量是
A.13g B.9.75g C.6.5g D.3.25g
8.一定量的铜粉与浓H2SO4共热产生二氧化硫气体2.24L(标准状况),则下列情况不可能的是
A.加入铜的质量为6.4g B.加入的浓硫酸中溶质为0.2mol
C.加入铜的质量大于6.4g D.加入的浓硫酸中溶质多于0.2mol
二、选择题(每小题有1个或2个选项符合题意)
9.标准状况下,在三个干燥的烧瓶内分别充入:纯净干燥的氨气,含一半空气的氯化氢气体,体积比为4:1的NO2和O2的混合气体。然后分别做喷泉实验,三个烧瓶内所得溶液的物质的量浓度之比为
A.2:1:2 B.5:5:4 C.1:1:1 D.无法确定
10.在C(HCO3-)=0.1mol·L-1的溶液中,可以大量共存的离子组是
A.Al3+、NO3-、NH4+、Cl- B.Na+、CO32-、K+、OH-
C.Na+、SO42-、K+、CH3COO- D.H+、Ba2+、Cl-、NO3-
11.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是
A.向CuSO4溶液中加入适量铁粉
B.等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C.等物质的量的NaHCO3与Na2O2固体
D.向NaBr中通入过量氯气
12.下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
B.氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓
C.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
D.氯化亚铁溶液中加入双氧水:2Fe2++H2O2+2H+=2Fe3++2H2O
13.对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:①加热时放出的气体可使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略显浅黄色,加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在原溶液中是否存在的是
A.Br- B.SO42- C.H2SO3 D.NH4+
14.将一定体积的CO2通入V L NaOH溶液中,已知两者恰好完全反应,若在反应后的溶液中加入足量的澄清石灰水,得到A g沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到B g沉淀,则下列说法不正确的是
A.标准状况下,参加反应的CO2体积为0.224A L
B.用上述数据不能确定NaOH溶液的浓度
C.若A=B,则CO2与NaOH溶液反应的产物只有Na2CO3
D.B不可能大于A
15.下面是实验室制取氨气的装置和选用的试剂,其中错误的是
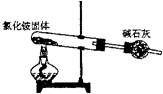


A. B. C. D.
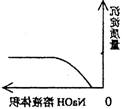
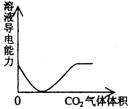
16.下列实验过程中产生的现象与对应的图形相符合的是
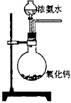
A.NaHSO3粉末加入HNO3溶液中 B.H2S气体通入氯水中
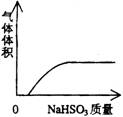
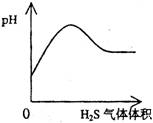
C.NaOH溶液滴入Ba(HCO3)2溶液中 D.CO2气体通入澄清石灰水中
17.某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A.NH4+ B.Mg2+ C.Fe2+ D.Al3+
18.0.03mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.46 C.50 D.66
三、填空题
19.在FeCl3和AlCl3混合溶液中先加入过量的NaI溶液,再加入足量的Na2S溶液,则所得的沉淀有 ,写出有关的离子方程式 ,
, , 。
20.用下图所示装置(气球内先充有空气)进行铜与稀硝酸反应的实验,请填写下列空格。
(1)实验开始时,先将烧瓶加热,其目的是 。
(2)在不断摇动烧瓶的条件下,使反应充分进行。可观察到4个主要现象:
①铜丝逐渐减少,但不完全消失,且表面有气泡生成;
②气球先略变大,在摇动情况下又变小,
 而后变大;
而后变大;
③ ;
④ ;
(3)摇动情况下,导致气球变小的有关反
应的化学方程式:
, 。
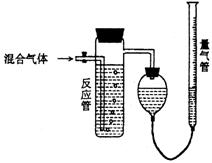 21.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图,反应管中装有碘的淀粉溶液,SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI(不考虑SO2、O2在水中相互反应)
21.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图,反应管中装有碘的淀粉溶液,SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI(不考虑SO2、O2在水中相互反应)
(1)混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量
(选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
(4)若碘溶液体积为VamL,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为 。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为
(选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶
e.量筒 f.单孔塞 g.双孔塞
22.A是中学化学中常见无机物,A、B、C中含有同一种元素R,不含R的产物已略去,有下图所示主要反应关系:

(1)A与NaOH溶液反应,既可只生成B,也可只生成C,还可以生成B和C。若A为氧化物,则A的化学式(写出两种): 、 。若A为气态氢化物,B中含有A中的两种元素,试写出C与稀H2SO4反应生成A的离子方程式: 。若A为一种铝盐,则B、C的化学式分别为: 、 。
(2)若A的单质与NaOH溶液无论何种物质的量之比反应,产物必为B和C。设R元素在A、B、C中的化合价分别为x、y、z,则x、y、z必须满足的大小关系是(用x、y、z表示): 。
23.莫尔盐是硫酸盐的一种复盐,它是一种重要的化学试剂,向它的水溶液中加入KSCN溶液不显红色。莫尔盐的水溶液有如下反应:

根据以上关系,按要求填空:
(1)气体B的分子式为 。
(2)莫尔盐的化学式为 。(不考虑结晶水)
(3)部分沉淀与稀硝酸反应的离子方程式为: 。
四、计算题
24.计算以下两小题时,除必须应用所有给出的数据外,还各缺少一个数据,指出该数据的名称(分别以a和b表示),并列出计算式。
(1)在一定温度和压强下,19.5g A与11.0g B恰好完全反应,生成固体C和3.00L的D气体,计算生成的C的质量(m)。
缺少的数据是:
计算式为:
(2)0.48g金属镁与10mL盐酸反应,计算生成的H2在标准状况下的体积(V)。
缺少的数据是:
计算式为:
25.某天然碱(纯净物)可看作由CO2和NaOH反应后的产物组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸30mL,产生CO2的体积(标准状况)如下表:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸溶液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品质量(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
(1)由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生CO2 mL(标准状况)。
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
(3)已知Na2CO3和HCl(a g)的反应分下列两步进行:
Na2CO3+HCl→NaCl+NaHCO3
NaHCO3+HCl→NaCl+CO2↑+H2O
由上表中第Ⅳ组数据可以确定所用的HCl(a g)的浓度为 mol·L-1(要有计算过程)。
第一学期期中考试
高三化学答卷
班级 学号 姓名 成绩
一、选择题(每小题只有一个选项符合题意)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
|
|
|
|
|
|
|
|
二、选择题(每小题有1个或2个选项符合题意)
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
|
|
|
|
|
|
|
|
|
|
三、填空题
19. , , ,
, 。
20.(1) 。
(2)③ ;
④ ;
(3) , 。
21.(1) 。(2) 。(3) 。
(4) 。(5) 。
22.(1) 、 。 。
、 。
(2) 。
23.(1) 。(2) 。
(3) 。
四、计算题
24.(1)缺少的数据是:
计算式为:
(2)缺少的数据是:
计算式为:
25.(1) 。
(2)
(3) mol·L-1。
【参考答案】
一、选择题
1.B 2.C 3.D 4.A 5.A 6.B 7.D 8.B
二、选择题(每小题有1个或2个选项符合题意)
9.B 10.C 11.BD 12.D 13.B 14.B 15.AC 16.D 17.AC 18.BC
三、填空题
19.Fe3、Al(OH)3 2Fe3++2I-=2Fe2++I2 Fe2++S2-=FeS↓
2Al3++3S2-+6H2O=2A(OH)3↓ I2+S2-=2I-+S↓
20.(1)提高反应速率
(2)③无色溶液变成蓝色 ④烧瓶中气体光影红棕色,最终无色
(3)2NO+O2=2NO2,3NO2+H2O=2HNO3+NO
21.(1)N2、O2 (2)偏低 (3)碘的品红溶液(酸性高锰酸钾、溴水)
(4)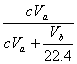 (5)ceg ( beg、bceg )
(5)ceg ( beg、bceg )
22.(1)CO2 SO2 S2-+2H+=H2S↑
Al(OH)3 NaAlO2
(2)y>x>z或z>x>y (x在y,z之间)
23.(1)NH3 (2)(NH4)2Fe(SO4)2
(3)3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O
四、计算题
24.(1)该温度压强下气体D的密度 ①
m=19.5g+11.0g-3.00L×a g/L ②
(2)盐酸的物质的量浓度 ①
V=![]() ②
②
25.(1) 504 (2)2Na2CO3·NaHCO3·2H2O (3)2.5