高三化学第一学期期终联考
试题
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,考试时间120分钟,总分150分,可能用到的相对原子质量H—1 C—12 O—16 Na—23 S—32 Cl—35.5
第工卷(选择题共72分)
一、选择题(本题包括8小题。每小题4分,共32分,每小题只有一个选项符合题意)
1、据报道,—个国际利学家小组利用加速器把锌原子加速,并在数周内不断撞击一张铅箔,从而得
到质量数为277的112号元素,其元素符号用Vub表示,该原子内的中子数和质子数之差是
A. 57 B. 112 C. 165 D. 53
2、下列叙述中正确的是
A.动物油是纯净物
B.动物油是高级脂肪酸的高级醇酯
C.动物油可以在碱性条件—卜加热水解
D.工业上将动物油加氢制造硬化油
3、下列物质不能用化合反应制取的是
A.CaCO3 B.Fe(OH)3 C.H2SiO3 D.FeCl2
4、关于晶体的下列说法正确的是
A.在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.分子晶体的熔点一定比金属晶体的低
高三化学试卷·第1页(共8页)
5.下列各组物质只用水不能鉴别开的是
A.CuSO4、Na2CO3、CaC2三种固体粉末
B.CH3OH、CH3CHO、![]() 三种液体
三种液体
C. ![]() 、CH3CH2OH、CCl三种有机溶剂
、CH3CH2OH、CCl三种有机溶剂
D.NaOH、NH4NO3、NaCl三种晶体
6.某金属单质跟一定浓度的硝酸反应,假定只生成单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是
A.NO2 B.NO C.N2O D.N2
7.在周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子
数之比为1:2,这些化合物有
A.1种 B.2种 C.3种 D.4种
8.NA表示阿佛加德罗常数,下列说法中不正确的是
A.在1L0.5mol·L—l的Na2CO3,溶液中,离子总数一定大于1.5NA个
B.在常温常压下nmolHD含有的核外电子数为2nNA
C.3.4gH2S气体在1.01x105Pa300℃时完全燃烧,需O2的分子数为0.15NA
D.在标准状况下,含4nmolHCl的浓盐酸与足量的MnO2反应生成nNA个C12
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括2个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题就为0分)
9.银锌电池广泛用做各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2![]() Ag2O+Zn+H2O,在银锌电池做电源时,正极上发生反应的物质是
Ag2O+Zn+H2O,在银锌电池做电源时,正极上发生反应的物质是
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
高三化学试卷·第2页(共8页)
10.常温时,将VlmLC1mol·L-1的氨水滴加到V2mLC2mol·L-1约盐酸中,下述结论中正确的是
A.若混合溶液的pH=7,则C1V1>C2V2
B.若Vl=V2,C1=C2则混合液中c(NH4+)=c(Cl-)
C.若混合液的pH=7,则混合液中c(NH4+)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则—定有C1<C2
11.在一定条件下,可逆反应:N2+3H2=2NH3,△H<0,达到平衡时,当单独改变下列条件后,有关
叙述错误的是
A.加催化剂V正、V逆都发生变化且变化的倍数相等
B.加压,V正、V逆都增大,且V正增大倍数大于V逆增大倍数
C.降温,V正、V逆都减小,且V正减小倍数大于V逆减小倍数
D.加入氩气,V正、V逆都增大,且V正增大倍数大于V逆增大倍数
12.常温下,某溶液中水电离出的c(H+)>1X10-7mol·L-1,则该溶液不可能的构成是
A.H+、Br-、S042-、K+ B.F-、Na+、K+、NO3-
C.Na+、NH4+、CH3COO-、SO42- D.K+、NO3-、Na+、Cl-
13.已知下列热化学方程式:Zn(s)+1/2O2(g)=ZnO(s);△H=-Ql;Hg(1)十1/2O2(g),=HgO(s);△H=-Q2则Zn(s)+HgO(s)=Hg(l)十ZnO(s);△H=-Q中的Q值为
A.Q2-Ql B.Q2+Q1 C.Q1-Q2 D. -Q1-Q2
14.下列离子方程式书写正确的是
A.用铂电极电解氯化镁溶液:Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.NaHSO4溶液中滴人Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-![]() BaSO4↓+H2O
BaSO4↓+H2O
C.在H2O2中加入酸性KMnO4溶液:2MnO4-+5H2O:+6H+![]() 2Mn2+ +5O2↑+8H2O
2Mn2+ +5O2↑+8H2O
D.稀HNO3中加入过量的Fe粉:Fe十4H+十NO3-![]() Fe3++NO↑+2H2O
Fe3++NO↑+2H2O
高三化学试卷·第3页(共3页)
15.由两种有机物组成的混合物,在一定温度和压强下完全汽化为气体。在相同的温度和压强下,只要混合气体的体积一定,那么无论混合物以何种比例混合,它在完全燃烧时所消耗的氧气体积也是一定的,符合这种情况可能是
A.乙醇(C2H6O和乙酸(C2H4O2) B.苯(C6H6)和苯甲酸(C7H6O2)
C.丙醛(C3H6O)和甘油(C3H8O3) D.丙酮(C3H6O)和丙二醇(C3H8O2)
16.以乙醇为原料,用下述6种类型的反应①氧化②消去③加成④酯化⑤水解⑥加聚,来
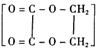 |
合成乙二酸乙二酯 正确顺序是
A.①⑤②③④B.①②③⑤④ C.②③⑤①④ D.②③⑤①⑥
17.在120℃1013KPa下,有由2L水蒸气,2L一氧化碳,1L二氧化碳,0.5L氧气和1L氢气组成的混合气体,将此混合气体通过足量铜粉,足量碳粉和足量氧化铜粉的3只灼热反应管。设每只反应管都能充分反应,而且不论这3只反应管以何种顺序排列,尾气中存在的气体可能是
A.H2和CO B.CO2和H2O C.H2O和CO D.CO2和CO
18.某温度下,若将Na2SO4溶液蒸发180g水,可变成饱和溶液。若向该溶液中加入14.2g无水Na2SO4也可变成饱和溶液。若在该溶液中加入Na2SO4·10H2O形成饱和溶液时所需Na2SO4·10H2O的质量至少为
A.14.2g B.32.2g C.35.8g D.46.4g
高三化学试卷·第4页(共8页)
第Ⅱ卷(非选择题共78分)
三、(本题包括2小题,共22分)
 19.(8分)(1)实验桌上有甲、乙两瓶气体,一瓶是H2,另—瓶是O2
19.(8分)(1)实验桌上有甲、乙两瓶气体,一瓶是H2,另—瓶是O2
如何用最简捷的方法判断何者为O2?
(2)在制取肥皂的实验中,加人乙醇是利用它 性质如何判断皂化反应已完成 。最后加入饱和NaCl溶液,现象是 。
20.(14分)甲、乙两个实验小组分别进行“Na2CO3和NaCl混合物中Na2CO3含量测定”的实验:
(1)甲组用沉淀分析法,把一定量的混合物溶解后加入足量的CaCl2,然后过滤,他们在用过滤 装置操作时,还要进行一项操作是 。在整个实验过程中,使用天平至少要 次。
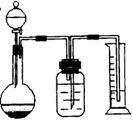 (2)乙组用气体分析法,把一定量的混合物与足量盐酸反应后,然后用如图装置测定产生的CO2气体的体积,请分析广口瓶中的溶液是
,
(2)乙组用气体分析法,把一定量的混合物与足量盐酸反应后,然后用如图装置测定产生的CO2气体的体积,请分析广口瓶中的溶液是
,
该装置测定的气体体积是否准确,说明理由:
。
(3)请你再设计一个与甲、乙组操作不同的实验方法,测定混
合物中的Na2CO3,含量。
方法是 。
用到的主要试剂是 (至少2种),
用到的仪器主要是 (至少2件)
高三化学试卷·第5页(共8页)
四、(本题包括2小题,共18分。)
21.(8分)化学中用类比的方法可预测许多物质的性质。如根据H2+Cl2![]() 2HCl推测:H2+Br2
2HCl推测:H2+Br2![]() 2HBr。但类同是相对的,如根据2Na202+2C02
2HBr。但类同是相对的,如根据2Na202+2C02![]() 2Na2CO3+O2类推:2Na2O2+2SO2
2Na2CO3+O2类推:2Na2O2+2SO2![]() 2Na2SO3+O2是错误的,应该为:Na2O2+SO2
2Na2SO3+O2是错误的,应该为:Na2O2+SO2![]() Na2SO4。
Na2SO4。
(1)下列各组类比中正确的是 。
A.由NH4Cl![]() NH3↑+HCl 推测:NH4I
NH3↑+HCl 推测:NH4I![]() NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O![]() CaCO2↓+2HClO
CaCO2↓+2HClO
推测:SO2+Ca(ClO)2+H20![]() CaSO3↓+2HClO
CaSO3↓+2HClO
C. 由2C02+Ca(ClO)2+2H2O![]() Ca(HCO)2+2HClO
Ca(HCO)2+2HClO
推测:C02+NaCIO+H20![]() NaHCO3+HClO
NaHCO3+HClO
D. 由Na2SO3+2HCl![]() 2NaCl+HcO+SO2↑
2NaCl+HcO+SO2↑
推测:Na2SO3+2HNO3![]() 2NaNO3+H2O+SO2↑
2NaNO3+H2O+SO2↑
(2)根据2NaCl+H2SO4(浓) ![]() Na2SO4+2HCl↑的反应推断例举一个制取类似气体的反应(写出反应方程式)
Na2SO4+2HCl↑的反应推断例举一个制取类似气体的反应(写出反应方程式)
(3)由氢氧化铁与盐酸反应生成氯化铁和水,应用有关化学知识,推断写出氢氧化铁与氢碘酸反应的化学方程式 。
(4)从2F2+2H2O![]() 4HF+O2反应预测2F2+4NaOH
4HF+O2反应预测2F2+4NaOH![]() 4NaF+2H2O+O2然而经试验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式
。
4NaF+2H2O+O2然而经试验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学反应方程式
。
22.(10分)已知甲、乙、丙是前三周期元素的单质,A、B、C、D、E、F、C、X均为常见化合物;在一定条下,各物质相互转化关系如下图所示:
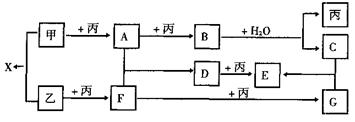
(1)写出X的电子式和C的化学式:X ,C 。
(2)摩尔质量相同的两种化合物的化学式是 。
(3)写出B+H2O反应的化学方程式 。
(4)工业生产上F与丙反应的压强条件是 。
高三化学试卷·第6页(共8页)
![]()
![]() 五、(本题包括2小题,共18分。)
五、(本题包括2小题,共18分。)
![]() 23.(8分)烷烃分子中的基团可能有四种:—CH3、—CH2—、—CH—、—C—,其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:
23.(8分)烷烃分子中的基团可能有四种:—CH3、—CH2—、—CH—、—C—,其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:
(1)下列说法正确的是
A.a的数目与b的数目的大小无关
B.c增加l,a就会增加3
C.d增加1,a就会增加2
D.b增加1,a就会增加2
(2)四种基团之间的关系为:a= (用a、b、c、d表示)
(3)若某烷烃分子中,b=c=d=1,则满足此条件的该分子的结构可能有 种,写出其中一种的名称 。
24.(10分)从某些植物树叶提取的挥发油中含有下列主要成分:
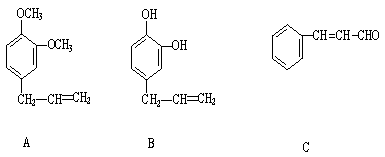
(1)写出A物质可能发生的反应类型(至少三种) 。
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)写出C在一定条件下与足量H2反应的化学方程式 。
(4)已知RCH=CHR’ ![]() RCOOH+R’COOH。写出c在强氧化剂条件下生成有机化合物
RCOOH+R’COOH。写出c在强氧化剂条件下生成有机化合物
的结构简式 。
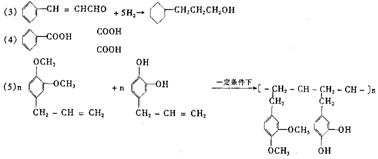
(5)写出A与B在一定条件下,生成高分子化合物的化学方程式:
高三化学试卷·第7页(共8页)
六、(本题包括2小题,共20分)
25.(8分)某温度下,取一定质量的硫酸铜溶液,用石墨作电极进行电解,当阳极产生标态下的气体1.12L时,CuSO4恰好被完全电解,得密度为1.2g/cm3的溶液200mL,求:
(1)电解后所得溶液的pH.
(2)电解前所取CuSO4溶液的质量.
(3)若要使电解后所得溶液恢复至电解前的原状态,需要加入一种什么物质,质量为多少克?
26.(12分)将固体FeC2O4·2H2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下:
| 温度℃ | 25 | 300 | 350 | 400 | 500 | 600 | 900 |
| 固体质量 | 1.000 | 0.800 | 0.800 | 0.400 | 0.444 | 0.444 | 0.430 |
根据计算分析推理,完成下列填空:
(1)写出25~300℃时固体发生变化的反应方程式 判断的理由是 。
(2)350~400℃发生变化得到的产物是 ,
物质的量之比为 。
(3)500℃时产物的含氧质量分数为 。
(4)写出600~900℃时发生变化的化学方程式 。
高三化学试卷·第8页(共8页)
第一学期期终四县联考
高三化学参考答案
一、选择题(每小题4分,共32分)
1.D 2.C 3.C 4.A 5.B 6.C 7.D 8.D
二、选择题(每小题4分,共40分)
9.C 10.A 11.CD 12.AD 13.C 14.C 15.BD 16.C 17.AB 18.C
三、(共22分)
19.(8分,每线2分)(1)正放的甲为氧气,(用余烬木条,爆鸣法不给分) (2)既能溶于碱,又能溶解油脂;取一滴反应混合物滴入水中,在液体表面不形成油滴; 肥皂发生凝聚而析出,浮在液面
20.(14分,每线2分)(1)沉淀的洗涤 3次 (2)饱和NaHCO3,溶液,不正确,少量HCl与NaHCO3,反应产生了CO2 (3)中和分析法(或中和滴定法,或用标准盐酸溶液滴定一定量的混和物溶液);标准盐酸溶液、甲基橙(指示剂也得分);滴定管,锥形瓶
四、(共18分)
21.(8分)(1)C (2)CaF2+H2SO4![]() CaSO4+2HFl(其它符合难挥发性酸制易挥发性酸的也得分)
CaSO4+2HFl(其它符合难挥发性酸制易挥发性酸的也得分)
(3)2Fe(OH)3+6HI:2FeI2+I2+6H2O (4)2F2+2NaOH 2NaF+OF2↑+H2O(每线2分)
22.(10分)(1)Na+[:![]() :]2-Na+, SO3 (2)Na2S,Na2O2
:]2-Na+, SO3 (2)Na2S,Na2O2
(3)2Na2O2+2H2O 4NaOH+O2↑ (4)常压
五、共(18分)
23.(8分)(1)AC (2)2+c+2d (3)3 2,2,3—三甲基戊烷(每线2分)(其它2种正确也给分)
24.(10分)(1)加成、取代、加聚等 (2)4
六,共(20分)
25.(8分)(1)pH=0(2分) (2)248g(2分) (3)CuO 8g或CuCO3 12.4g(4分)
26.(12分)(1)FeC2O4·2H2O![]() FeC2O4+2H2O,加热减少的质量等于所含结晶水的质量(其它有理也给分) (2)FeO、CO、CO2, 1:1:1 (3)30%
FeC2O4+2H2O,加热减少的质量等于所含结晶水的质量(其它有理也给分) (2)FeO、CO、CO2, 1:1:1 (3)30%
(4)6Fe2O3![]() 4Fe3O4+O2↑(每线各2分)
4Fe3O4+O2↑(每线各2分)
高三化学答案·第1页(共1页)