高三化学复习检测
基本概念
(总分:110分 时间:50min)
答题时可能用到的相对原子质量:Na-23 C-12 O-16 P-31 Cl-36.5 Cu-64 Fe-56
第Ⅰ卷 (选择题共4 5 分)
本卷共 9 小题,每小题5分, 共 45 分。每小题只有一个选项符合题目要求。
1.某物质的溶液既能使蓝色石蕊试液变红,也能与碳酸盐反应生成气体,此物质有可能是
①氧化物 ②盐 ③碱 ④单质 ⑤酸
A.①②④ B . ①②④⑤
C.② D . ①②③④⑤
2.在下列各说法中,正确的是( )。
A.△H > 0 kJ·mol-1表示放热反应,△H < 0 kJ·mol-1表示吸热反应
B.热化学方程式中的化学计量数表示物质的量,可以是分数
C.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热
3.去年“非典”在我国广东流行,民间都用过氧乙酸(CH3COOOH)作为消毒剂,因它具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢,有关过氧乙酸的叙述不正确的是
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸与苯酚混合使用杀菌能力更强
C.过氧乙酸因具有强氧化性,所以有杀菌作用
D.在使用过氧乙酸消毒时并不是浓度越大越好
4.以 NA 表示阿佛加德罗常数,下列说法正确的是
A.10.6gNa2CO3 固体中,含 0.1NA个CO 32 -
B .1摩尔甲基中含有7 NA个电子
C .31g 白磷中含有 NA 个 P - P 键
D .2g 重氢中含有2 NA个质子
|
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原时,一定得到金属单质
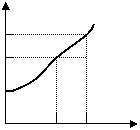 6.有一种盐A,它的溶解度曲线如图一(见下页)。现有盐A的溶液,其组成处于图中的 P 点,试根据图中的信息分析判断,下列说法中错误的是(已知盐A的晶体不含结晶水)
溶解度
6.有一种盐A,它的溶解度曲线如图一(见下页)。现有盐A的溶液,其组成处于图中的 P 点,试根据图中的信息分析判断,下列说法中错误的是(已知盐A的晶体不含结晶水)
溶解度
A .把该溶液温度降低 20 ℃,该溶液可变为 50
饱和溶液 40 ·P
B .50℃时,向溶液组成为 P 的A盐溶液加
入 10gA盐,溶液可变为饱和溶液 温度℃
C .从图判断: 50 ℃时,若配成盐A的饱和 30 50
溶液,则其质量分数约为33.3% ( 图一 )
D .50℃时,若组成为 P 的A盐溶液含 Bg A盐,
则加入 B/4 g A盐,溶液即变为饱和溶液
7.下列各说法中,正确的是( )。
A.凡是能发生银镜反应的物质都是醛
B.乙烯和甲苯都能使酸性高锰酸钾溶液褪色
C.在氧气中燃烧只生成二氧化碳和水的有机物一定是烃
D.苯酚有弱酸性,它是一种羧酸
8.在化学反应中,反应前与反应后相比较,肯定不变的是
①元素的种类 ②原子的种类 ③分子数目 ④原子数目 ⑤反应前物质的质量总和和反应后物质的质量总和 ⑥如果在水溶液中反应,则反应前与反应后阳离子所带的正电荷总数
A.①②③④ B . ①②⑤⑥ C . ①②④⑤ D . ②③⑤⑥
9.将常温常压下的aL氯化氢气体溶于100g水中,得到的盐酸的密度为bg·mL-1,则该盐酸的物质的量浓度
第Ⅱ卷 (非选择题 共4小题,65分)
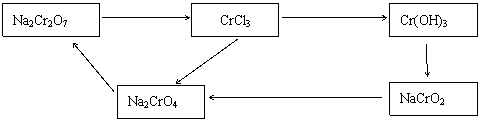
10.(15分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境中排放该种有害物质。例如:
 ①
②
①
②
⑤ ④ ③
(1)在上述有编号的步骤中,需要用还原剂的是 ,需要用氧化剂的是 (填编号) 。
(2)在上述循环中,既能与强酸又能与强碱反应的两性物质是 (填化学式)。
(3)完成并配平步骤 ① 的 化学方程式,标出电子转移方向和数目:
( )Na2Cr2O7 +( )KI + ( )HCl → ( )CrCl3 + ( )NaCl
+( )KCl + ( )I2 +( )
12.(18分)试样X由氧化亚铁和氧化铜组成。取质量相等的两份试样按下图所示进行实验:
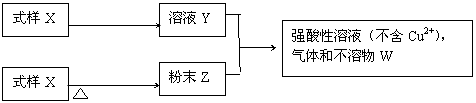 ①过量盐酸
①过量盐酸
③
②过量CO
完全反应
(1)请写出步骤 ① ③ 中所发生的全部反应的离子方程式。
、
、 。
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每包试样X中氧化铜的质量为 (用m表示)。
3.(12分)往20mL的0.2mol·L-1NaOH溶液中,缓缓通入一定量CO2气体,将溶液在一定条件下蒸干。若得到的白色固体是纯净物,则通入CO2的体积是 (标准状况)。将上述白色固体加水溶解,加盐酸至PH=7,再蒸干,得到白色固体的质量应为 g。
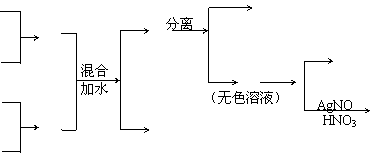
13.(20分)A、B、C、D四种元素原子的核电荷数依次增大,它们都在20以内,能发生如下反应:
 A
J(胶状沉淀)
A
J(胶状沉淀)
E G
C 焰色反应:紫色
I
B
白色沉淀
F H(臭蛋味气体)
D
请回答下列问题:
(1)写出A元素的原子结构示意图
(2)写出B和D形成的化合物的电子式
(3)C元素常见的化合价
(4)写出化合物E与氨水反应的离子方程式
。
高三化学复习检测基本概念
参考答案和评分标准
第Ⅰ卷答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案标号 | B | B | C | A | A | B | B | C | C |
![]() 10.(15分)(1)①
、 ④ (2)Cr(OH)3 (每空3分) 6e
10.(15分)(1)①
、 ④ (2)Cr(OH)3 (每空3分) 6e
(3)1、6、14==2、2、6、3、7 H2O(3分) Na2Cr2O7 +6 KI(3分)
11.(18分)(1)① FeO +2H+==Fe2++2H2O 、 CuO+2H+==Cu2++H2O
③ Fe + Cu2+==Fe2++Cu 、 Fe +2H+==Fe2++H2↑(每个方程式3分)
(2)5m/8 (6分)
12.(12分)44.8mL或89.6mL(各4分,无单位各扣2分)。0.234 (4分)。
13.(20分)每空5分。
 (1)Al :
(1)Al :
+13 283
![]()
(2)K2S : K+ K+
(3)-1、+1、+3、+5、+7
(4) Al3++3NH3·H2O == Al(OH)3↓+3NH4+