高三化学复习检测基本理论
第Ⅰ卷(选择题 共54分)
选择题:共9个小题。每小题6分,共54分。每小题只有一个选项符合题意。
1.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是 ①电子数 ②最外层电子数 ③电子层数 ④次外层电子数 其中正确的是
A ①② B ②③ C ③④ D ①④
2.在下列有关晶体的叙述中错误的是
A 离子晶体中,一定存在离子键 B 原子晶体中,只存在共价键
C 金属晶体的熔沸点均很高 D 稀有气体的原子能形成分子晶体
3.在常温下10mL pH=10的KOH溶液中,加人pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述
① c(A-)=c(K+) ② c(H+)=c(OH-)<c(K+)<c(A-)
③ V总≥20mL ④ V总≤20mL 其中正确的是
A ①③ B ②④ C ①④ D ②③
4.在pH=1的无色溶液中能大量共存的离子组是
A NH4+、Mg2+、SO42-、Cl- B Ba2+、K+、OH-、NO3-
C Al3+、Cu2+、SO42-、Cl- D Na+、Ca2+、Cl-、AlO2-
5.1 mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:
X(g)
+ a Y(g) ![]() b Z(g)
b Z(g)
反应达到平衡后,测得X的转化率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值不可能是
A.a=l ,b=l B.a=5 ,b=3 C.a=2 ,b=2 D.a=3 ,b=2
6.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
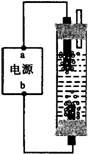 A a为正极,b为负极;NaClO和NaCl
A a为正极,b为负极;NaClO和NaCl
B a为负极,b为正极;NaClO和NaCl
C a为阳极,b为阴极;HClO和NaCl
D a为阴极,b为阳极;HClO和NaCl
7.下列叙述正确的是
A 干冰汽化时碳氧键发生断裂
B CaO和SiO2晶体中都不存在单个小分子
C Na2O和Na2O2所含的化学键类型完全相同
D 溴蒸汽被木炭吸附时共价键被破坏
8.下列事实不能用勒沙特列原理解释的是
A 开启啤酒瓶后,瓶中马上泛起白色泡沫
B 实验室常用排饱和食盐水的方法收集氯气
C 工业上生产硫酸的过程中使用过量的空气以提高SO2的利用率
D 合成氨工业使用500℃的高温以提高单位时间的产量
9.从下列实验事实所引出的相应结论正确的是
| 选项 | 实验事实 | 结论 |
| A | 盐酸中加入相同温度的氨水,反应混合液的温度上升 | 盐类水解过程是吸热的 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有改变 | 催化剂一定不参与化学反应 |
| C | 在常温下N2很难与金属化合 | 氮元素的非金属性很弱 |
| D | 钢比铝容易锈蚀 | 钢中的铁不如铝活泼 |
高三化学复习检测
基本理论
班学生 得分
第Ⅰ卷答案表
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案标 号 |
第Ⅱ卷(非选择题 共66分)
10.(20分)致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期: > >H2O、HF;
第三周期: SiH4>PH3> > 。
(2)化合物的毒性:PH3>NH3 H2S H2O;
CS2 CO2 CCl4 > CF4 (选填>或<、=)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其它类似的还可以是 。
(4)然而,这种致冷剂造成了当今的某一环境问题是 。
但求助于周期表中元素及其化合物的 变化趋势来开发致冷剂的科学思维方法是值得借鉴的。(填写字母,多选扣分)
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
(a)①②③ (b)②④⑤ (c)②③④
11.(14分)将2mol H2O和2mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g) ![]() 2H2 +O2
2H2 +O2
2CO + O2 ![]() 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是________和________,或________和 ________。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为n(O2)平 = a mol,n(C02)平 = b mol。 试求n(H2O)平 = ________________。(用含a、b的代数式表示)
12.(16分)用实验确定某酸HA是弱电解质。两位同学的方案是:
甲:①称取一定质量的HA配制0.1mol / L的溶液100mL;②用PH试纸测出该溶液的PH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制PH=1的两种酸溶液各100mL;②分别取这两种溶液各10mL,加水稀释至100mL;③各取相同体积的两种稀释液装入两个试管,同时加入相同纯度的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第一步中,都要用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的PH 1(选填>、<、=)。乙方案中,说明HA是弱电解质的现象是 (选填标号,多选扣分):(A)装HCl的试管中放出气体的速率快;(B)装HA溶液的试管中放出气体的速率快;(C)两个试管里产生气体的速率一样快。
(3)请你评价,乙方案中难以做到之处:
难以做到; 难以做到。
(4)请你再提出一个合理而最容易进行的方案(药品可任取),作简明扼要表述。 。
13.(16分)由实验得知,用电解法将电解液中的金属离子还原为金属单质时,电极所通过的电量Q正比于金属的物质的量n和金属离子的化合价a的乘积,其比例系数F是一恒量称为法拉第常数。它与金属的种类无关。已知:
阿伏加德罗常数:NA= 6.02×1023mol-1 电子电量:e = 1.6×10-19C M(Cu) = 64g · mol-1
①试求法拉第常数F(电量以库为单位,保留三位有效数字)
②如果电解CuSO4溶液获得1kg的金属铜,通过电解槽的电量是多少?
高三化学复习检测
基本理论
参考答案、提示及评分标准
第Ⅰ卷答案
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案标 号 | D | C | C | A | C | B | B | D | A |
第Ⅰ卷提示
3.关键:PH= 4的一元酸HA可以是强酸,也可以是弱酸。若为强酸,
V(HA)=V(KOH),V(总)= 20mL;若为弱酸,则c(HA)> c(KOH),V(KOH)>V(HA), ∴V(总)≤20mL,④正确。PH= 7,则c(H+) = c(OH-),根据电荷守恒得c(K+) = c(A-),∴①正确。
4.注意关键词:“无色”,则C不正确。而B、D中的OH-、AlO2-都使溶液显碱性,不符合题意。
![]()
![]() 5.
X + aY bZ 根据阿佛加德罗定律,同温同压同
5.
X + aY bZ 根据阿佛加德罗定律,同温同压同
n 起始(mol) 1 a 0 质量的气体,其物质的量与密度成
n 变化(mol) 0.5 0.5a 0.5b 反比。∴有:(1+a)=(0.5+0.5a+0.5b)
n平衡(mol) 0.5 0.5a 0.5b ×4/3 ,化简得a = 2b-1,仅C不符。
6.提示:①“为使氯气能完全吸收”,应在电解槽下部产生氯气,即与电极b相连的电极,可让氯气与阴极生成的NaOH充分反应;②a、b是电源的电极,应以正、负极命名。
9.A:盐类水解是中和反应的逆反应,中和放热,其逆反应必然吸热。
B:在有机反应中,好多催化剂都参与化学反应。
C:氮分子不活泼是因为其分子内部的三键键能大,不易断裂。
D:钢容易生锈是因为发生电化学腐蚀,而铝的表面的氧化铝起保护作用。
第Ⅱ卷答案
10.(20分)(1)CH4>NH3,H2S>HCl(各2分,共4分)
(2)> ,>(各2分,共4分) 提示:由已知可推出,第三周期元素的化合物的毒性比第二周期的强。
(3)CFCl3 (或CF3Cl) (4分)
(4)使大气臭氧层出现空洞(4分) (5)(a)(4分)
11.(14分)(1)H2O、H2 ;CO、CO2 (各4分,共8分)
提示:建立化学平衡计算模式,可推出上述结论。
(2)(2-2a-b) mol (6分,无单位扣3分)
提示: 2CO + O22CO2 2H2O(g)2H2 + O2
起始(mo) 2 (a+b/2) 0 2 0 0
变化(mol) b b/2 b (2a+b) (2a+b) (a+b/2)
平衡(mol) (2-b) a b 2-(2a+b)
12.(16分)(1)100mL容量瓶 (2分)(2)> ;B(各2分,共4分)
(3)配制PH = 1的HA溶液;取表面积相同的两份锌粒。(各2分,共4分)
(4)配制任意浓度的NaA溶液,测定其PH值,若大于7,则证明HA是弱电解质。(6分)
13.(16分)
①解:由题意,有:F = eNA = 1.6×10-19C×6.02×1023mol-1
= 9.63×104C·mol-1 (8分,无单位扣2分)
②解:
![]()
= 3.0×106 C 。(8分)