高三化学寒假作业2
一、选择题(每小题3分,共60分。每小题只有一个选项符合题意。)
1.下列各组物质中不易用物理性质区别的是 ( )
A. 苯和四氯化碳 B. 酒精和汽油
C. 氯化铵和硝酸铵晶体 D. 碘和高锰酸钾固体
2.下列物质中,密度比水大的是 ( )
A. 氯乙烷 B. 四氯化碳 C. 苯 D. 乙酸乙酯
3.已知丁基共有四种。不必试写,立即可断定分子式为C5H10O的醛应有 ( )
A. 3种 B. 4种 C. 5种 D. 6种
4. 下列反应的离子方程式正确的是 ( )
A. 碳酸钙溶于醋酸 CaCO3+2H+ =Ca2++CO2↑+H2O
B.澄清石灰水中加入盐酸 Ca(OH)2+2H+ =Ca2++2H2O 01春
C.铜片加入稀硝酸中 Cu+![]() +4H+ =Cu2++NO↑+2H2O
+4H+ =Cu2++NO↑+2H2O
D.小苏打溶液和甲酸混合 ![]() +HCOOH=HCOO-+CO2↑+H2O
+HCOOH=HCOO-+CO2↑+H2O
5.下列操作中错误的是 ( )
A 除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯
B 除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层
C 除去CO2中的少量SO2;通过盛有饱和NaHCO3溶液的洗气瓶 02春
D 提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,取出有机层再分离
6.随着人们生活节奏的加快,方便的小包装食品已经被广泛接受,为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是 ( )
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.白磷、碱石灰 D.生石灰、食盐
7.苯甲酸(C6H5COOH)和山梨酸(CH3-CH=CH-CH=CH-COOH)都是常用的食品防腐剂。下列物质中只能与其中一种酸发生反应的是 ( )
A. 金属钠 B. 氢氧化钠 C. 溴水 D. 乙醇
8.2001年9月1日将执行国家食品卫生标准规定,酱油中3-氯丙醇(CH3CH2CH2OH)含量不得超过1 ppm,相对分子质量为94.5的氯丙醇(不含![]() 结构)共有
( )
结构)共有
( )
A. 2种 B. 3种 C. 4种 D. 5种 01上海17
9.下列物质中,不属于羧酸类有机物的是 ( )
A. 乙二酸 B. 苯甲酸 C. 硬脂酸 D. 石炭酸
10.有机物甲可氧化生成羧酸,也可还原生成醇,由甲生成的羧酸和醇在一定条件下,可以生成化合物乙,其分子式为C2H4O2。下列叙述中不正确的是 ( )
A. 甲分子中C的质量分数为40% B. 甲在常温常压下为无色液体
C. 乙比甲的沸点高 D. 乙和甲的最简式相同 02春
11.分子式为C5H12O2的二元醇,有多种同分异构体,其中主链上碳原子数为3的同分异构体数目为m,主链上碳原子数为4的同分异构体数目为n,下列各组数据中m和n均正确的是(不包括一个碳原子上连接两个羟基的化合物) ( )
| A | B | C | D | |
| m | 1 | 1 | 2 | 2 |
| n | 6 | 7 | 6 | 7 |
12.某共价化合物含C、H、N三种元素,分子内有4个氮原子,且4个氮原子排列成内空的正四面体(如白磷结构),每两个氮原子间都有一个碳原子。已知分子内无C—C键和C=C键。则该化合物的分子式为 ( )
A. C4H8N4 B. C6H12N4 C. C4H12N4 D. C6H10N4
13.2002年9月14日南京汤山发生了一起震惊全国的特大投毒案,犯罪分子在食品中投入了毒鼠剂——毒鼠强,导致200多人中毒,42人抢救无效死亡;已知毒鼠强的结构简式
如右图,有关毒鼠强(化学名:四亚甲基二砜四氨)的下列相关说法正确的是 ( )
A.毒鼠强属于无机物 B.毒鼠强属于烃
C.四个氮原子构成正四面体 D.毒鼠强的分子式为C4H8N4S204
14.下列物质中能溶于水的是 ( )
A. 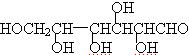
B. 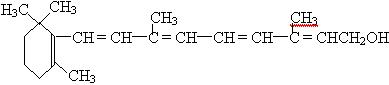
C. 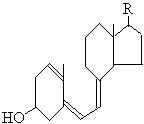
D. CH3CH2CH2CH=CH2
15.下列除杂方法中正确的一组是 ( )
A. 溴苯中混有溴,加入碘化钾溶液后用汽油萃取
B. 乙醇中混有乙酸,加入NaOH溶液后用分液漏斗分液
C. 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气
D. 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏
16.将甲基、羟基、羧基和苯基四种不同原子团,两两结合后形成的化合物的水溶液呈酸性的有机物有 ( )
A. 2种 B. 3种 C. 4种 D. 5种
17.某气态化合物X含C、H、O三种元素,现已知下列条件:① X中C的质量分数,② X中H的质量分数,③ X在标准状况下的体积,④ X对氢气的相对密度,⑤ X的质量。欲确定化合物X的分子式,所需的最少条件是 ( )
A. ①②④ B. ②③④ C. ①③⑤ D. ①②
18.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓硫酸作用下发生反应,一段时间后,分子中含有18O的物质有 ( )
A. 1种 B. 2种 C. 3种 D. 4种
19. 某同学在实验报告中记录下列数据,其中正确的是
A.用25mL量筒量取12.36mL盐酸
B.用托盘天平称取8.75g食盐
C.用标准的NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10mL
D.用广泛pH试纸测得某溶液的pH为3.5
20.某物质可能有甲醇、甲酸、乙醇、甲酸乙酯几种物质中的一种或几种,在鉴定时有下列现象:① 有银镜反应,② 加入新制Cu(OH)2悬浊液,沉淀不溶解,③ 与含有酚酞的NaOH溶液共热时发现溶液中红色逐渐变浅至无色。下列叙述中正确的是 ( )
A. 有甲酸乙酯和甲酸
B. 有甲酸乙酯和乙醇
C. 有甲酸乙酯,可能有甲醇
D. 几种物质都有
二、(本题包括4小题,共22分)
21.(4分)A、B、C、D、E五种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
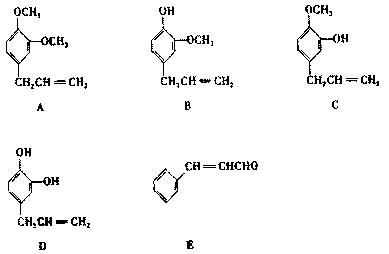 |
请回答下列问题:
(1) 这五种化合物中,互为同分异构体的是
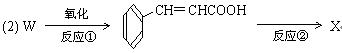
反应①采取了适当措施,使分子中烯键不起反应。
以上反应式中的W是A~E中的某一化合物,则W是
X是D的同分异构体,X的结构简式是 。反应②属于 反应(填反应类型名称)。
22.(5分)有机物A、B互为同系物,B比A多一个碳原子。A、B、C、D、E五种有机物存在,如下反应关系:
![]()
E具有果香味,其相对分子质量为102。
⑴ A的名称是____________,C中含有的官能团是_____________;
⑵ 写出B的同分异构体的结构简式(只写同类的)_____________________________;
⑶ 加热A到170℃,在浓硫酸的作用下发生分子内脱水生成F,其化学方程式为
_________________________________________________________;
⑷ 写出E的结构简式____________________
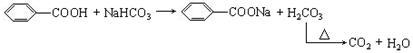
23.(7分)某芳香化合物A的分子式为C7H6O2,溶于NaHCO3,将此溶液加热,能用石蕊试纸检验出有酸性气体产生。
(1)化合物 A的结构简式为:
(2)依题意写出化学反应方程式:
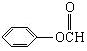
(3)A有 个属于芳香族化合物的同分异构体,写出它们的结构简式。
24.(6分)已知CH2=CH-CH3与水加成生成2-丙醇(![]() ),2-丙醇可氧化成丙酮:
),2-丙醇可氧化成丙酮:![]() ,1-溴丙烷在氢氧化钠水溶液下共热生成1-丙醇,
,1-溴丙烷在氢氧化钠水溶液下共热生成1-丙醇,![]() 。试以1-丁烯为主要原料合成:
。试以1-丁烯为主要原料合成:![]() ,写出有关的化学方程式。
,写出有关的化学方程式。
(1) ___________________________________________________________;
(2) ___________________________________________________________;
(3) ___________________________________________________________;
(4) ___________________________________________________________;
(5) ___________________________________________________________;
(6) ___________________________________________________________。
三、(本题包括2小题,共12分)
25.(4分)某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成C,C能使石蕊试液变红。
已知: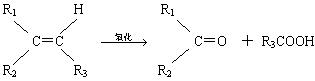
试写出:
(1)A的分子式 00上海30
(2)化合物A和C的结构简式:
A C
(3) 与C同类的同分异构体(含C)可能有 种
26.(8分)某学生用图示装置(Ⅰ)制取溴苯和溴乙烷。已知溴乙烷为无色液体,难溶于水,沸点:38.4℃,熔点:-119℃,密度为1.46 g / cm3。主要实验步骤如下:
① 检查气密性后,向烧瓶中加入一定量苯和液溴。
② 向锥形瓶中加入乙醇和浓硫酸的混合液至恰好没于进气导管口。
③ 将A装置中纯铁丝小心向下插入混合液中。
④ 点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10 min。
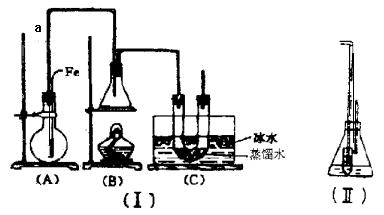
请填写下列空白:
(1) 步骤③时,观察到的现象是 。
(2) 导管a的作用是 。
(3) C装置中U型管内用蒸馏水封住管底的作用 。
(4) 反应完毕后,U型管内的现象是 ;分离出溴乙烷时所用最主要仪器名称是(只填一种) 。
(5) 步骤④中可否用大火加热,理由是 。
(6) 为证明溴和苯的上述反应是取代反应而不是加成反应,该学生用装置(Ⅱ)代替装置B、C直接与A相连接重新反应。
① 装置(Ⅱ)的锥形瓶中,小试管内的液体是(填名称) ,其作用是 ;小试管外的液体是(填名称) ,其作用是 。
② 反应后,向锥形瓶中滴加 (填化学式)溶液,现象是
,其作用是 ;装置(Ⅱ)还可起到的作用是 。
四、计算题(6分)
27. 将N2和 H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:
(1)反应前混合气体中N2和 H2的体积比;
(2)达到平衡时混合气体中的氨的物质的量;(3) 平衡时N2的转化率。
答 案
一、1. C 2. B 3. B 4. D 5. A 6. B 7. C 8. B 9. D 10. B 11. C 12. B 13. D
14. A 15. D 16. B 17. A 18. C 19. C 20. C
 二、21. (1) B和C (2) E;
;还原(或加成、加氢、催化加氢等)
二、21. (1) B和C (2) E;
;还原(或加成、加氢、催化加氢等)
22. ⑴ 乙醇;醛基 ⑵ CH3CH2CH2OH CH3CH(OH)CH3 ⑶
![]() ⑷ CH3COOCH2CH2CH3或CH3COOCH(CH3)2
⑷ CH3COOCH2CH2CH3或CH3COOCH(CH3)2
23.(1)![]()
(2)
(3)4;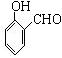 、
、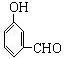 、
、![]() 、
、
24. CH3CH2CH=CH2+Br2 → CH3CH2CHBr-CH2Br
CH3CH2CHBr-CH2Br+2H2O ![]() CH3CH2CHOH-CH2OH+2HBr
CH3CH2CHOH-CH2OH+2HBr
![]()
![]()
![]()
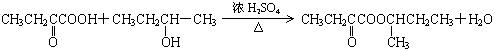
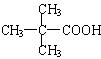
三、25.(1)C10H20
(2)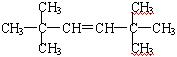 ;
;
(3)4种
26. (1) 剧烈反应,液体沸腾,烧瓶上方及a中有棕红色气体 (2) 导气,冷凝回流 (3) 溶解HBr,防止HBr及产物逸出 (4) 液体分层,下层为无色油状液体;分液漏斗 (5) 不可;易发生副反应生成乙醚、乙烯等 (6) ①苯;吸收挥发出的溴蒸气;水;吸收HBr气体 ②AgNO3;生成淡黄色沉淀;检验Br- ;证明发生取代反应生成HBr;防倒吸
四、27. ⑴V(N2):V(H2)= n(N2): n(H2) =1:4 ⑵平衡时 n(NH3)==0.12 mol
⑶平衡时的N2转化率60%