高三化学元素化合物综合练习(二)
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.下列物质相互反应能产生可燃性气体的是
①炭块投入浓硝酸中②铁片投人稀硫酸中③过氧化钠投入水中④电石投入食盐水中
A.①③ B.②④
C.①④ D.②③④
2.2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
A.单质钠的密度比钾的密度小 B.钠和钾在空气中燃烧的产物都是过氧化物
C.钠和钾都是短周期元素 D.钠和钾的合金[ω(K)=50%-80%]在室温下呈液态
3.工业上利用下述反应在真空中炼铷:2RbCl+ Mg==MgC12+2Rb。这一反应能进行的原因是
A.在高温下镁的金属活泼性比铷强
B.铷的沸点比镁低,以气体形式被抽去
C.铷的熔点比镁低,以液体形式被抽去
D.MgC12的稳定性比RbCl的强
4.某金属硝酸盐受热分解生成金属氧化物、二氧化氮和氧气。若生成的二氧化氮和氧气的物质的量之比为8∶1,则金属元素的化合价在反应过程中的变化是
A.升高 B.降低 C.不变 D.无法确定
5.“绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放。下列反应类型一定符合这一要求的是 ①取代反应 ②加成反应 ③消去反应 ④水解反应 ⑤加聚反应 ⑥缩聚反应 ⑦酯化反应
A.② B.②⑦ C.①⑥ D.②⑤
6.氟气是氧化性最强的非金属单质。在加热条件下,等物质的量氟气与烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是
A.H2 B.HF C.O2 D.OF2
7.下列化工生产过程中的反应,不涉及氧化还原反应的是
A.用石灰石、石英、纯碱生产玻璃 B.用空气、水、煤制硝酸铵
C.用黄铁矿、磷矿石制过磷酸钙 D.以铝土矿为原料冶炼铝
8.在搪瓷和陶瓷器皿具表面的釉质中含有极微量的Pb、Cd、Sb等有毒金属盐类,为防止中毒,不能长期盛放下列物质的是
A.酱油 B.食醋 C.蔗糖 D.食盐
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.下列各级溶液中,常温下不用其他试剂,仅仅利用它们之间的相互反应就可以将它们区别开的一组是
A.CuSO4 BaCl2 NaOH Ba(NO3)2 B.FeCl2 Na2SO4 AlCl3 NaOH
C.Ca(OH)2 NaCl Na2CO3 BaCl2 D.BaCl2 KNO3 Na2CO3 Na2SO4
10.下列离子方程式正确的是
A.Ba(OH)2溶液滴加入到NaHSO4溶液中至溶液呈中性:
Ba2+ + OH— + H+ +SO42— = BaSO4↓+ H2O
B.Na2CO3溶液中滴加盐酸至刚好出现气泡时停止:CO32—+2H+ = CO2↑+H2O
C.碳酸氢钙溶液跟稀硝酸反应:HCO3—+H+ = CO2↑+H2O
![]() D.氯化铁溶液中通入SO2气体:Fe3+ +SO2
+2H2O = Fe2+ +SO42— + 4H+
D.氯化铁溶液中通入SO2气体:Fe3+ +SO2
+2H2O = Fe2+ +SO42— + 4H+
|
A.加热后有不溶于水的油状物生成 B.混合液蒸干后得到的固体物质是KOH
C.电解时两极均有气体产生 D.得到的有机物为1,2-二氯乙烷
12.有下列两种说法:
①一种碱溶液与一种盐溶液混合反应后,产物之一是强碱性物质;
②两种酸溶液伸混合反应后,溶液的酸性减弱。
其中确有具体例证存在的是 A.只有① B.①和② C.只有② D.都不存在
13.将m gFe2O3和FeS组成的混合物溶解在足量的盐酸中,结果得到n g沉淀,则原混合物中FeS的质量为
①5n g ②(m-5n)g ③(m-1/4n)g ④11n/4g
A.①② B.③④ C.①③ D.②④
14.1L1.00mol·L-1的纯碱溶液逐滴加入到1L1.25mol·L-1的盐酸中;再做相反操作:将1L1.25mol·L-1的盐酸逐滴加入到1L1.00mol·L-1的纯碱溶液中,两次操作在同温同压下产生气体的体积比是
A.2:5 B.1:1 C.2:1 D.5:2
15.硫代硫酸钠是分析化学中常用试剂,已知硫代硫酸钠有下列性质:Na2S2O3+CO2+H2O=
NaHCO3+NaHSO3+S↓;2Na2S2O3+O2=2Na2SO4+2S↓;Na2S2O3![]() Na2SO3+S↓。通常配制标准硫代硫酸钠溶液时,为防止变质,需用煮沸后经冷却的蒸馏水,还需加入少量的碳酸钠和少量的另一种试剂,这种试剂是
Na2SO3+S↓。通常配制标准硫代硫酸钠溶液时,为防止变质,需用煮沸后经冷却的蒸馏水,还需加入少量的碳酸钠和少量的另一种试剂,这种试剂是
A.硫酸 B.亚硫酸钠 C.硫 D.碘化汞(HgI2)
16.空气和二氧化碳按体积5:1混合,将混合气体与足量的红热焦炭充分反应。设空气中氮气和氧气的体积比为4:1,不计其他成分,且体积都在同温、同压下测定的,则反应后的气体中一氧化碳的体积分数是
A.29% B.43% C.50% D.100%
17.有三组物质:①NO2和Br2蒸气②C2H5CHO、C6H6、C6H5-NO2三种无色液体③CaC2、CuSO4(无水)、CaCO3、Na2SO4、干燥的碱石灰(含少量酚酞)五种固体,只用水就能区别开的是
A.① B.①② C.②③ D.①②③
18.汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的一种办法是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,并促使烃类充分燃烧及SO2的转化,下列说法中错误的是
A.CO与NO反应的化学方程式为2CO+2NO![]() 2CO2+N2
2CO2+N2
B.此方法的缺点是由于CO2的增多,会大大提高空气的酸度
C.为减少城市污染应开发新能源
D.汽车尾气中有两种气体会与血红蛋白结合而使人中毒
三、简答填空(16分)
19.(9分)A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、X的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈现的化合价依次递增,其中只有B为单质;
②常温下将气体D通入水中发生反应,生成C和E;
③工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答以下问题:
(1)B的电子式为 ,A的结构式为 ,A分子的空间构型是
;
(2)写出②中涉及反应的化学方程式 ;
(3)由B反应生成1mol A放出的热量为46.2kJ,写出该反应的热化学方程式,并注明
反应条件 ;
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式 。
20. (7分)硝酸工业中尾气中N的氧化物(NO、NO2)是主要的大气污染之一,其常用的治理方法中有以下两种(已简化)。
①NaOH吸收法,反应原理如下:
2NO2+2NaOH=NaNO3+NaNO2+H2O NO+NO2+2NaOH=NaNO2+NaNO2+H2O
②氨催化还原法,反应原理是:
NOx+NH3![]() N2+H2O(未配平)
N2+H2O(未配平)
现有一定量的含NO2和NO的硝酸工业尾气(不含其他气体),若用过量的NaOH吸收后溶液中NaNO3和NaNO2的物质的量之比恰好与原尾气中NO和NO2的物质的量之比相等。
(1)若用NOx表示该尾气中氮的氧化物的平均组成,试求x的值。
x=__________________________________________。
(2)将1体积的该尾气用②的方法处理,至少消耗相同状况下的NH3的体积为____________。
(3)配平下列方程式:
______NOx+_____NH3=______N2+_____H2O
四、分析推理(18分)
21.(8分) 已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。从溶 液中将C u2+、Fe2+、Fe3+沉淀为氢氧化物所需pH值分别为6.4,6.4,3.7。 现有氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制取纯净的CuCl2·2H2O, 首先将其制成水溶液,然后按下图步骤进行提纯

现有可供选择的试剂组:
| A | B | C | D | |
| X | H2O2 | KMnO4 | NaClO | K2Cr2O7 |
| Y | CuO | Cu(OH)2 | CuO | CuCO3 |
回答下列问题:
(1)最合适本实验的试剂组是 。
(2)加氧化剂的目的是 。
(3)本实验用加碱沉淀法直接除去FeCl2能达到目的吗?为什么?
。
(4)最后能否直接蒸发结晶,应如何操作?
。
22.(10分)从固体混合物A出发可以发生如下框图所示的一系列变化
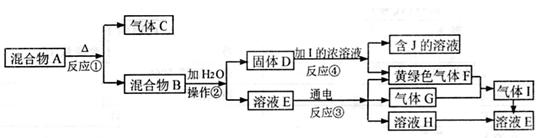
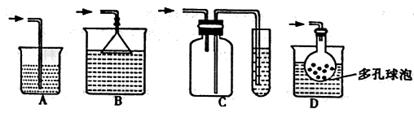
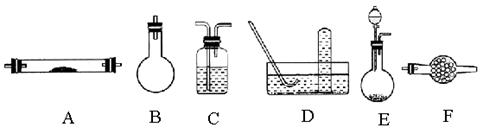
(1)在实验室中收集气体C,可选择右图装置中的 (填选项字母)
(2)操作②的名称是 ,在操作②中所使用的玻璃仪器的名称是 ,在得到固体D时必须进行洗涤、干燥等操作。洗涤固体D的操作方法
 是
。
是
。
(3)写出下列反应的化学方程式或离了方程式:
反应①
反应③
反应④
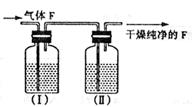 (4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过如下示意图中的装置,其中瓶I中盛放的是
,瓶II中盛放的是:
。
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过如下示意图中的装置,其中瓶I中盛放的是
,瓶II中盛放的是:
。
(5)实验中多余的气体F必须吸收,以免污染空气。下图是实验室用NaOH吸收气体F的装置,为防止产生倒吸现象,合理的装置是 。
|
五、实验探究(10分)
23.(10分)实验室可通过多条途径得到氮气,常见的三种方法是:
方法一,将氨气通入灼热的氧化铜粉末,得到纯净氮气和铜。
方法二,将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三,将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,逸出氮气。
|
请回答下列问题:
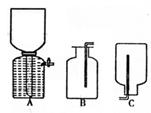
(1)方法一制氮气;氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号) 作发生装置,该反应的化学方程式
。要制取并收集纯净的氮气(可含有少量的水),还使用上述仪器中的(填仪器的编号,并按气流方向人左向右列出)
。
(2)在制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。这两种方法与方法三相比,其优越性在于
。
六、计算题(10分)
24.(10分)现有Na2O2和NaHCO3固体混合物0.06mol,在密闭容器中加热到250℃,让其充分反应后排出气体(包括水蒸气),冷却,称得残留固体质量为Ag。设混合物中Na2O2
为xmol(0<x<0.06),当x取不同数值时,气体的成分、残留固体成分会发生变化。请完
成下表(A值可以用包含x的式子表示):
| x值 | 气体成分 | 残留固体成分 | A值 |
| 0<x<0.02 | Na2CO3 | ||
| H2O 、O2 | A=4.24 | ||
| H2O 、O2 | Na2CO3、NaOH | A=3.96+14x | |
| x=0.03 | O2 | A=4.38 | |
| 0.03<x<0.06 | Na2CO3、NaOH 、Na2O2 |
元素化合物综合练习(二)
参考答案
| 1 | B | 2 | B | 3 | B | 4 | A | 5 | D |
| 6 | D | 7 | A | 8 | B | 9 | B | 10 | C |
| 11 | C | 12 | B | 13 | D | 14 | D | 15 | D |
| 16 | C | 17 | D | 18 | B |
| |||
19.(共15分)(1):N::N: H—N—H 三角锥形(答案合理均给分)
(2)3NO2+H2O=2HNO3+NO (3)N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol
(4)8NH3+3Cl2=6NH4Cl+N2
20.(1)1.75
(2)1.17
(3)3,2x,(3+2x)/2,3x
[提示](1)由反应方程式及题意,设n(NO2)∶n(NO)=k(k>1)
又设:NO为1mol,则NO2为kmol。
NO+NO2+2NaOH=2NaNO2+H2O
1 1 2
应有NO消耗量为1mol,生成NaNO2为2mol,余NO2为(k-1)mol。
2NO2 + 2NaOH ==== NaNO2 + NaNO3 + H2O
2 1 1
k-1
![]() (k-1)
(k-1) ![]() (k-1)
(k-1)
共生成NaNO3,NaNO2分别为![]() (k-1),[
(k-1),[![]() (k-1)+2]
(k-1)+2]
∵[![]() (k-1)+2]/[
(k-1)+2]/[![]() (k-1)]= k
(k-1)]= k
∴k=3即n(NO2)∶n(NO)=3∶1
NOx中x值为:[2×3+1]/(3+1)=2-![]() =1.75
=1.75
(2)由方程式:
NOx+yNH3→N2↑+xH2O
由含氧量守恒有:2x=3y
∴y=![]() =1.17
=1.17
(3)用1,n法配平:首先NOx前系数定为1,NH3前为n。
利用原子个数守恒,配平N、H元素:
1NOx+nNH3=![]() N2+
N2+![]() H2O
H2O
∵“O”原子个数守恒:
∴x=![]() ∴n=
∴n=![]()
把n值代回原式,有:
1NOx+![]() NH3=
NH3=![]() N2+xH2O
N2+xH2O
去分母有:3NOx+2xNH3=![]() N2+3xH2O
N2+3xH2O
21.(1)A;
(2)将FeCl2氧化成FeCl3,以便于与CuCl2分离
(3)不能,加碱时Cu2+同时沉淀为难溶物
(4)不能,应在HCl气氛中蒸发(或加盐酸条件下蒸发)。
22.(20分)(1)AB
(2)过滤 漏斗、烧杯、玻璃棒向漏斗里注入蒸馏水,
|
|
|
|
反应③:2KCl+2H2O=====2KOH+H2↑+Cl2 (或2Cl-+2H2O====2OH-+H2↑+Cl2↑)
反应④MnO2+4HCl(浓)====MnCl2+Cl2↑+2H2O(或MnO2+4H++2Cl-====Mn2++Cl2↑+2H2O)
(4)饱和NaCl溶液,浓H2SO4
(5)BCD
23.(1)E CaO+NH3·H2O=NH3↑+Ca(OH)2
E→F→A→C→D
(2)Cu和CuO可以循环使用,避免因使用有毒的物质NaNO2而造成污染。
24.
| x值 | 气体成分 | 残留固体成分 | A值 |
| CO2、H2O 、O2 | A=3.18+53x | ||
| x=0.02 |
| Na2CO3 | |
| 0.02<x<0.03 | |||
|
| Na2CO3、NaOH | ||
| O2 |
| A=4.08+10x |