高三化学元素化合物综合练习(四)
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.美国“9·11”恐怖袭击事件给纽约带来了一场严重的环境灾难—石棉污染,易使吸入石棉纤维者患肺癌。已知石棉是硅酸盐矿物,某种石棉的化学式可表示为
Ca2MgXSiYO22(OH)2,X、Y的值分别为
A.8,3 B.5,8 C.3,8 D.5,5
2.为缓解华北地区的旱情,有关部门选择适宜的条件和方法,向大气中发射催雨剂,其主要成分是干冰、液氮、碘化银等。下列有关叙述不正确的是
A.干冰和液氮的固体都是分子晶体
B.干冰和液氮的分子中都有非极性共价键
C.干冰和液氮催雨的原理属于物理变化
D.碘化银微粒在冷云中产生冰晶,起到催雨作用
3.为保证青少年和儿童的健康成长,每天饮用的水应含有一定量的钙、镁等离子。目前市售的“蒸馏水”、“纯净水”因不含有钙离子、镁离子,不宜长期、大量饮用。为保证青少年儿童的健康成长,这些饮用水应添加一些化学物质。这些微量添加物应该是
A.精盐 B.漂白粉 C.钙和镁的碳酸氢盐 D.明矾
4.液溴易挥发,实验室保存时加适量水形成水封,液面仍充满红棕色的溴蒸气。先将试剂
瓶倾斜,缓缓地向试管中倾倒,则可以观察到首先被倒入试管的是
A.液溴 B.水 C.溴蒸气和溴水 D.溴蒸气和液溴
5.我国科学前不久成功地合成了3mm长的管状碳纳米管,长度居世界之首。这种碳纤维具有强度高。刚度(抵抗变形的能力)高、密度小(只有钢的25%)、熔点高,化学稳定性好的特点,因此被称为“超级纤维”。下列对碳纤维的说法中不正确的是
A.它是制造飞机的理想材料 B.它的主要组成是碳元素
C.它的结构与石墨相似 D.碳纤维复合材料不易导电
6.下列有关碱金属元素及其化合物的叙述:①碱金属元素的次外层电子数是2或8; ②碱金属元素位于元素周期表的第IA族;③碱金属的氯化物都是强电解质;④碱金属最高价氧化物的水化物都是强碱。其中正确的是
A.只有② B.只有④ C.只有①②④ D.①②③④
7.对于下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.反应CuSO4+H2S==CuS↓+H2SO4能进行,说明硫化铜既不溶于水也不溶于稀硫酸
8.“过氧化氢”(H2O2)被称为“绿色漂白剂”,下列叙述中不正确的是
A.H2O2分子中含有O2-离子
B.纯H2O2是液体,能与水以任意比例混合
C.H2O2常用作医用消毒剂
D.在酸性溶液中H2O2是强氧化剂,而还原性较弱
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.在含有Cu(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中,加入铁粉,经反应后未见气体放出,当析出3.2gCu时,溶解的铁粉的质量是
A.5.6g B.2.8g C.14g D.8.4g
 10.实验室里常见的如右图所示的仪器,该仪器为两头密封的玻璃窗,中间带有 一根玻璃短柄。当玻璃管内装有感片时,用此仪器进行碘的升华实验,具有装置简单、 操作方便、现象明显、可反复使用等优点。用此仪器不能反复进行的实验是
10.实验室里常见的如右图所示的仪器,该仪器为两头密封的玻璃窗,中间带有 一根玻璃短柄。当玻璃管内装有感片时,用此仪器进行碘的升华实验,具有装置简单、 操作方便、现象明显、可反复使用等优点。用此仪器不能反复进行的实验是
A.NH4Cl受热分解的实验
B.KMnO4受热分解的实验
C.白磷和红磷在一定温度下相互转变的实验
D.无水CuSO4与胆矾的互变实验
11.标准状况下将盛满NO、NO2、O2混合气的集气瓶倒置于水槽中,完全溶解, 无气体剩余。则所得溶液物质的量浓度c数值范围为(设产物不扩散)
A.0 < c<![]() B.
B.![]() < c<
< c<![]()
C.![]() < c<
< c< ![]() D.
D.![]() < c<
< c< ![]()
12.有Na2CO3、AgNO3、BaCl2、HCl、NH4NO3 5瓶无标签的溶液,为鉴别它们,取4支试管分别装入一种溶液,再向上述4支试管中加入少许剩下的一种溶液,下列表达中错误
的是
A.若3支试管出现沉淀时,则后加入的是AgNO3溶液
B.若全部没有什么现象变化时,后加的是NH4NO3溶液
C.若1支试管出现气体,2支试管出现沉淀时,最后加入的是HCl溶液
D.若只有2支试管出现沉淀其他试管均无明显现象时,则后加的是BaCl2溶液
13.下列各组溶液,不用其它试剂就可以将它们区别开的是
①KOH、K2CO3、MgSO4、KHSO4 ②NaNO3、HCl、NH4Cl、KOH
③BaCl2、CaCl2、Na2SO4、AgNO3 ④AlCl3、NaOH、NaHCO3、MgCl2
A.①④ B.①③ C.②④ D.②③
14.A、B、C、D、E分别是 Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:(1)A、C均能与稀 H2SO4反应放出气体;(2)B与D的硝酸盐反应,置换出单质D;(3)C与强碱反应放出气体;(4)C、E在冷浓H2SO4中发生钝化反应,由此可以推断A、 B、 C、 D、E依次为
A.Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe
C.Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe
15.将8gFe2O3投入150 mL某浓度的稀硫酸中,再投入7g铁粉,共收集到1.68LH2(标况),同时Fe和Fe2O3均无剩余。向溶液中滴入KSCN溶液,未见颜色变化。为了中和过量的H2SO4,且使Fe2+恰好完全转化为Fe(OH)2沉淀,共消耗4mol/L的NaOH溶液150mL。则原H2SO4的物质的量浓度为
A.1 mol/L B. 2 mol/L C.3 mol/L D. 4 mol/L
16.下列根据实验现象的判断中,正确的是
A.能使湿润的碘化钾淀粉试纸变蓝的气体一定是氯气
B.在潮湿的空气中能形成白雾的气态氢化物一定是氯化氢
C.溶于水中能形成无色溶液的棕色气体一定是二氧化氮
D.能用于做喷泉实验的气体只能是氨气或氯化氢
17.微量硒元素对人体有保健作用,已知硒与氧同主族,与钾同周期,下列有关硒元素的性质描述错误的是
A.硒既能溶于盐酸又能溶于烧碱溶液
B.硒的非金属性比溴弱,
C.硒的最高价氧化物的化学式为SeO3
D.硒的气态氢化物的化学式为 H2Se
18.有四位学生设计了下列四个方案确证溶液中含SO42-,你认为合理的是
BaCl2溶液 足量盐酸
![]()
![]() A.方案甲:试液
白色沉淀
沉淀不溶解
A.方案甲:试液
白色沉淀
沉淀不溶解
BaCl2溶液 足量硝酸
![]()
![]() B.方案乙:试液
白色沉淀
沉淀不溶解
B.方案乙:试液
白色沉淀
沉淀不溶解
足量硝酸 Ba(NO3)2溶液
![]()
![]() C.方案丙:试液
无沉淀
白色沉淀
C.方案丙:试液
无沉淀
白色沉淀
足量盐酸 Ba(NO3)2溶液
![]()
![]() D.方案丁:试液
无沉淀
白色沉淀
D.方案丁:试液
无沉淀
白色沉淀
三、简答填空(18分)
19.(7分) 碳的稳定的氧化物除CO、CO2外,还有C3O2、C4O3、C5O2、C12O9等低氧化物,其中C3O2是一种在常温下有恶臭的气体,其分子中的每个原子都满足最外层8电子结构。假设在一定条件下 CH3COOH→CH2=C=O+H2O。
①C3O2分子的电子式为___________;
②在上述碳的低氧化物中,若有分子空间构型与 C3O2相同的,最可能是___________;
③不考虑反应条件,根据你现有的化学知识判断, O2、HCl能与 C3O2发生反应,请将能够反应的化学方程式写在下面。
_______________________________________,_____________________________________,
20. (11分) (1) 某无色透明的溶液,跟金属铝反应时放出H2,试判断下列离子: Mg2+、 Cu2+、 Ba2+、H+、Ag+、SO42一、HCO3一、OH一、NO3一在下述两种情况中,可能存在于此溶液中的是:
① 当与铝反应后生成Al3+时,原溶液可能存在的离子是____________________。
② 当与铝反应后生成AlO2一时,原溶液可能存在的离子是____________________。
(2)拉曼·光谱表明溶液中不存在AlO2-离子,实际存在[Al(OH)4]- 离子,在200mL0.2mol/L Na[Al(OH)4]溶液中逐滴加入0.2mol/L H2SO4溶液250mL,试回答:
①写出分两步反应的离子方程式____________________,_________________________。
②反应完全后,溶液中Al3+离子与SO42-离子的物质的量之比为___________。
四、分析推理(16分)
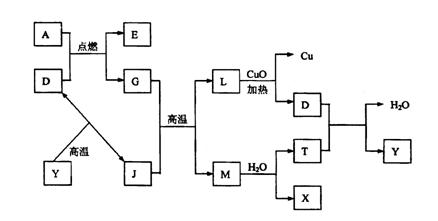
21.(8分)如图所示:
|
其中A、G是固体单质,其余是化合物。X是常用于切割和焊接金属的可燃性气体;Y
是一种难溶于水的白色固体,它的式量是100。
请填空:
(1)D的电子式是 。
(2)A跟D反应的化学方程式是 ;
该反应的反应热△H
0(填“<、=、>” ![]() 。
。
(3)在高温条件下,G跟J反应的化学方程式是 。
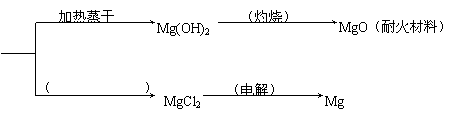 22.(8分)已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
22.(8分)已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
MgCl2·6H2O
请回答下列问题:
(1)在上图中的括号内填写适当的反应条件。
![]() (2)Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固) Mg2++2OH—。向体系中加入(至少填出两种不同类别的物质)
,有利于Mg(OH)2溶解。
(2)Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固) Mg2++2OH—。向体系中加入(至少填出两种不同类别的物质)
,有利于Mg(OH)2溶解。
(3)NaF和MgO的核间距离分别为2.31×10-10m和2.10×10×10-10m,但两者的熔点分别为993℃和2852℃。试解释其可能的原因
。
(4)依据绿色化学的原子经济的概念(即化学反应的原料中每个原子都参与反应并全部转化为产物),203 kg MgCl2·6H2O原料可以获得29.8 kg MgO、 kg36.5%盐酸和 kg MgCl2。
五、实验探究(10分)
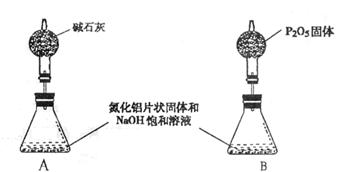
23.(10分)氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域。其制备反应原理为:Al2O3+N2+3C 2AlN+3CO。制备过程中,原料配比不当或反应不完
全等因素都会造成产品中含有碳或Al2O3等杂质。为测定产品中AlN的质量分数,某同
学按下图装置进行相关实验。可选用的化学试剂为:
![]() 氮化铝片状固体、NaOH饱和溶液、水、煤油、医用酒精。
氮化铝片状固体、NaOH饱和溶液、水、煤油、医用酒精。
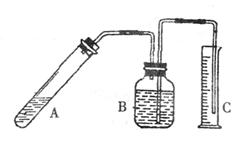 回答下列问题:
回答下列问题:
(1)简述检查该套装置气密性的方法
。
(2)右图B中试剂最好选用(填序号):
。
①水 ②煤油 ③医用酒精
已知A 中有NaAlO2生成,并放出有刺激性气味气体,写出A中发生反应的化学方程式
。
(3)读取C(量筒)中液体体积时,应注意 。(填序号)
a.C中液面不再上升时立即读数 b.上下移动C,使之液面与B中液面相平
c.A中不再有气泡逸出 d.视线与凹液面最低处相平
(4)mg氮化铝与足量NaOH饱和溶液反应,实验结束后,C中收集到液体的体积为VL(已折算成标准状况),则AlN样品的纯度为 (写计算表达式)。
(5)上述实验方案,可能因气体体积测量不准,导致误差较大。有人建议改用下列A、B两个装置中的一种(在通风橱内进行),只需进行简单而又必要的数据测写,用差量法就
|
六、计算题(10分)
|
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.00 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
| 硫的质量/g | 1.28 | 1.92 | 2.56 |
(1)样品与硫酸可能发生反应的离子方程式为 。
(2)根据上表数据分析,该样品 (填选项字母)
|
B.含有Na2S2O3和Na2SO3两种成分
C.含有Na2S2O3、Na2SO3和Na2SO4三种成分
(3)试计算:该样品中各成分的物质的量之比。
(4)求所加硫酸溶液的物质的量浓度是多少?
(5)若将63 g该样品与一定量的该硫酸溶液微热,欲计算生成SO2的体积,还需要提供的一个数据是(用a表示该数值,并注明单位) 。
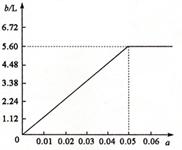
试讨论:当a在不同取值范围时,SO2的体积b.并请在图上画出b随a变化的曲线。
元素化合物综合练习(四)
参考答案
| 1 | B | 2 | B | 3 | C | 4 | C | 5 | D |
| 6 | D | 7 | C | 8 | A | 9 | D | 10 | B |
| 11 | D | 12 | C | 13 | A | 14 | C | 15 | B |
| 16 | C | 17 | A | 18 | D |
| |||
19. ① :O::C::C::C::O: ② C5O2 ③ C3O2 +2O2==3CO2
O=C=C=C=O+2HCl→ClCOCH2COCl
20.⑴①Mg2+、 SO42一、H+ ② Ba2+、OH一、NO3一
⑵① [Al(OH)4]- + H+= Al(OH)3 ↓+ H2O
Al(OH)3+ 3H+ ==Al3++3 H2O
②2:5
|
|
(2)2Mg+CO2=====2MgO+C,小于(3) CaO+3C=====CaC2+CO↑
22.(1)在干燥的氯化氢气流中加热
(2)酸类:盐酸、硫酸、硝酸等,强酸弱碱盐类:硫酸铜、氯化铁等
铵盐类:醋酸铵等 (其它合理答案均给分)
(3)两种物质同是离子晶体,MgO比NaF键长短(或MgO比NaF核间距离小),Mg2+、O2-所带电荷多(离子之间作用力大),离子晶体的熔点也显著升高。(4)149kg 24.2kg
提示:n(MgO)=29.8×103g÷40g·mol-1=745mol
n(HCl)=2n(MgO)=745mol×2=1490mol
m(36.5%盐酸)=1490mol×36.5mol-1÷36.5%=149kg
根据质量守衡m(MgCl2)=203kg-29.8kg-149kg=24.2kg
(或n(MgCl2)=1000mol-745mol=255mol)
m(MgCl2)=255mol×95g·mol-1=24225g=24.2kg
23.(1)将C中导管浸入水中,微热试管A,C中导管出口有气泡逸出。冷却后,C中导管仍有高出液面的水柱不下降。(或先在B中加入煤油,然后将试管A放入冰水中,B中导管有气泡进入B,将试管A恢复室温,B中导管有高出液面的油柱不下降。)(其它合理答案均可给分)
(2)② AlN+NaOH+H2O=NaAlO2+NH3↑
(3)b,c,d (4)![]() (5)A
(5)A
24.解:(1)S2O32—+2H+ S↓+SO2↑+H2O SO32—+2H+ SO2↑+H2O (2)C
三份样品质量比为:12.60 g : 18.90 g : 28.00 g = 1:1.5:2.2
三份样品生成硫的质量比为:1.28 g : 1.92 g : 2.56 g = 1:1.5:2.0
故第一、二份样品完全反应第三份样品过量
若样品全为Na2S2O3·5H2O,则生成![]()
若样品全为Na2SO3,则生成![]()
故样品中含Na2SO4,又![]() ∴样品中含Na2SO3
∴样品中含Na2SO3
综上,样品中含有Na2S2O3·5H2O、Na2SO3、Na2SO4。答案C。
(3)选择第一份样品所提供的数据计算如下:![]()
由Na2S2O3+H2SO4 Na2SO4+ S
+ SO2↑ +H2O
0.04 mol 0.04mol 0.04mol
可知![]()
![]()
所以![]()
(4)第三份样品因过量故H2SO4全部反应。
|
![]()
故消耗n(H2SO4)=0.08 mol+0.02 mol=0.1 mol
![]()
(5)硫酸溶液的体积a L(或a mL)
设63 g样品中含x mol Na2SO3
则含Na2S2O3·5H2O为4x mol Na2SO4 x mol 则有:248×4x+126x+142x=63 x=0.05 mol
当0<a<0.05时,b=112a L 当a=0.05时,b=112a L=5.6 L 当a>0.05时,b=5.6 L