高三化学元素化合物综合练习(一)
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.下列各组中两种浓溶液相混合时既无沉淀析出又无气体放出的是
A.Ba(HCO3)2 NaHSO4 B.NaHCO3 Al2(SO4)3
C.Mg(HCO3)2 CaCI2 D.Na2SiO3 HCl
2.下列物质发生变化,因反应条件或反应物的用量不同,能够得到不同生成物的是 ① Na和 O2 ②C2H5OH和浓 H2SO4 ③Ca3(PO4)2和 H2SO4 ④AlCl3和 NaOH ⑤Cu和HNO3
A.①③ B.①④⑤ C.除②③外 D.全部
3.在F、P、Si、Fe这四种元素中,每种元素都有某些方面区别于其它三种元素,若从中选出氟元素,选择的理由中正确的是
A.最高价氧化物对应的水化物酸性最强
B.单质与冷水反应最剧烈
C.单质固态时为分子晶体,熔沸点较低
D.在氧化物:OF6 、P2O5 、Fe2O3 中,OF6最稳定
4.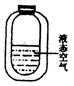 如图,保温瓶中装有液态空气,打开瓶盖,将一根燃着的木条置于瓶
如图,保温瓶中装有液态空气,打开瓶盖,将一根燃着的木条置于瓶
口的上方,下列说法正确的是
A.木条燃烧更旺,因为瓶内液态空气汽化后,产生O2
B.木条燃烧情况不发生改变,因为瓶内盛放的也是空气
C. 木条熄灭,因为瓶内液态空气汽化后,使环境温度降低,且先产生N2,不支持燃烧
D.木条先燃烧更旺,后熄灭,因为瓶内液态空气汽化后,先产生O2后产生N2
5.三氟化氮(NF3)是一种无色无味的气体,它是氨(NH3)和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是
A.NF3是离子化合物 B.NF3的还原性比NH3强
C.NF3的氧化性比F2强 D.NF3中的N呈+3价
6.人造骨是一种具有生物功能的新型无机非金属材料,它类似于人骨和天然牙的性质和结构,可以依靠人体体液中补充某些离子形成新骨,在骨骼接合界面发生分解、吸收、析出等反应,实现骨骼牢固结合。人造骨植入人体内形成新骨需吸收人体中的
A.Na+、CO32— B.K+、Cl- C.Fe3+、NO3- D.Ca2+、PO43-
7.某盐A跟某酸B反应,生成刺激性气味的气体C,C与烧碱溶液反应生成A,C氧化可生成D,D跟烧碱溶液在常温下反应,生成物中也有A,下列各组物质符合题意的是
A.Na2SO3和H2SO4 B.NaHCO3和稀盐酸
C.Na2S和稀盐酸 D.NaCl和浓H2SO4
8.下列实验室制备有关物质的方法中,合理又实用的是
A.用含少量Cu2+的稀硫酸和锌粒反应制氢气
B.煅烧石灰石制备二氧化碳
C.用NH4Cl溶液和Ca(OH) 2溶液反应制氨气
D.用FeCl3溶液和NaOH溶液反应制Fe(OH) 3胶体
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.已知亚磷酸(H3PO3)只能生成两种钠盐(NaH2PO3和Na2HPO3),由此可知下列说法中不正确的是
A.亚磷酸中磷+3价 B.亚磷酸有氧化性和还原性
C.亚磷酸是二元酸 D.亚磷酸只有两种酸式盐而无正盐
10.C12通入石灰乳中得漂白粉,其主要成分可写成为 Ca(OH)2·3CaCl(ClO)·nH2O。过量HCl和漂白粉作用生成Cl2的质量和漂白粉质量之比称为“有效氯”。现有一种漂白粉的“有效氯”为35%,若该漂白粉的组成和上述化学式相符,则式中 n值应为
A.6.5 B.8 C.8. 5 D.10
11.一定量的Mg和MgO的混合物投入100ml 2mol/L的稀HCl中完全溶解后,再向反应后的溶液中加入4mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小是
A.100ml B.50ml
C.25ml D.由于Mg、MgO的质量未知无法判断
12.2001年闹得沸沸扬的“毒粉丝事件”,是粉丝中掺入吊白块。吊白块学名为甲醛次硫酸氢钠,它能使粉丝漂白,但在粉丝中残留甲醛等有毒物质,严重危害人体健康。它可由NaHSO3和HCHO在一定条件下反应制得:NaHSO3+HCHO→NaO—CH2—SO3H该反应的类型是
A.取代反应 B.加成反应 C.聚合反应 D.消去反应
13. a mol FeS与b mol FeO投入到V L、c mol•L—1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④(Vc-![]() )mol
)mol
A.①④
B.②③ ![]() C.①③
D.②④
C.①③
D.②④
14.某白色固体可能是由①NH4Cl 、②AlCl3、③NaCl、④AgN03、⑤KOH中的一种或几种组成。将此固体投入水中,得澄清溶液,该溶液可使酚酞呈红色,向该溶液中加稀硝酸至过量,有白色沉淀产生。以下对原固体的判断中不正确的是
A.肯定存在① B.至少存在①④⑤
C.无法确定是否有③ D.至少存在②和⑤
15.为了鉴别硫酸溶液和水,某研究性学习小组设计了5种方案:
①用量筒量取相同体积的两种液体,分别置于两只相同的烧杯中,置于托盘天平两托盘
上,质量较大者为硫酸溶液
②取样,分别加入无色酚酞试液,能使酚酞变色的是硫酸溶液
③以电导装置分别测试它们的导电性,导电能力强的是硫酸溶液
④在两种液体的试样中,分别加入少量铁粉,铁粉溶解且生成浅绿色溶液的是硫酸溶液
⑤取两块完全相同的小木块,分别置于两种液体中,露出体积大者是硫酸溶液
你认为上述方案中不合理的是
A.只有② B.只有①② C.只有②③④ D.全部
16.某地有甲、乙两工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同离子):Ag+、Ba2+、Fe3+、Na+、Cl-、CO32-、NO3-、OH-。若两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便变成无色澄清只含硝酸钠而排放,污染程度会大大降低。关于污染源的分析,你认为正确的是
A.CO32-和NO3-可能来自同一工厂 B.Na+和NO3-来自同一工厂
C.Ag+和Na+可能在同一工厂 D.Cl-和NO3-一定不在同一工厂
17.对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+等微粒)。分别进行如下实验:①加热时放出的气体可使品红溶液褪色②加碱调pH至碱性后,加热时放出的气体可使润湿的红色石蕊试纸变蓝③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀NHO3。对于上述微粒不能确认其在原溶液中是否存在的是
A.Br- B.SO42- C.H2SO3 D.NH4+
18.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A.21:5 B.11:3 C.3:1 D.4:1
三、简答填空(18分)
19.(8分)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸
及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2(二氟化氙)
和KBrO3首先制得BrO4-,不久得到纯净KBrO4晶体。
(1)已知XeF2与水反应生成O2和氙气,氟则以化合态留在水溶液中,每生成1molO2,
转移电子数 mol。该反应的氧化剂是 。
(2)写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式是
。
(3)根据上面的信息,指出BrO4-的稳定性与pH的关系 。
20.(10分)阳离子Na+、Ag+、Mg2+、Cu2+和阴离子Cl-、NO3-、OH-、SO42-两两组成(不
重复)A、B、C、D四种可溶性化合物,它们起反应时的现象如下:
A+B→白↓, B+D→白↓,C+D→蓝↓
由此判断:A ,B ,C ,D 。(写化学式)
上述生成沉淀的离子方程式为:(1) ,
(2) ,
(3) 。
四、分析推理(16分)
21.(5分)A~H是中学化学的常见物质,其中E、F、G是单质,B的化学式是E2F3,它们有如下图转化关系:

(1)A、F、H的化学式分别是 、 、 。
(2)C+E反应的化学方程式是 。
(3)简要说明A·6H2O可转变为C和D的原因是 。
22.(11分)据下列信息完成所需回答的问题:
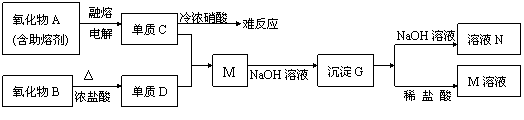
(1)A是 ,D是 ,G是 (填化学式)
(2)元素C位于周期表中第 周期 族。
(3)写出下列反应的离子方程式
B+浓盐酸
G+NaOH溶液
(4)单质C不与冷浓硝酸反应的原因是
(5)已知一定质量的B与足量的浓盐酸反应生成的D在标准状况下的体积为5.6L,求
被氧化的HCl的物质的量。(写出计算过程)
五、实验探究(10分)
23.(本小题共10分) 某课外活动小组加热炭份(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验,请你帮助他们完成下列实验报告。
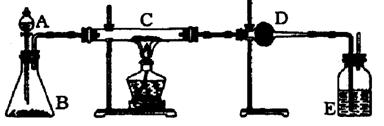
(一)实验目的:_________________________________。
(二)实验用品:
仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、
酒精灯、洗气瓶等
药品:红褐色铜粉(含炭)样品、过氧化氢溶液,二氧化锰、碱石灰、浓硫酸等
(三)实验内容;
| 实验步骤 |
|
|
| 在C中加入样品粉 末wg,D中装入药 品后并称重量为mg 连接好仪器后,检查气密性 | ||
| 打开A的活塞,慢 慢滴加溶液 | ||
| 对C进行加热。 当C中的药品充分 反应后。关闭A的 活塞,停止加热 |
|
|
| 冷却后,称量D的 质量为m2 g |
(四) 计算:样品中铜的质量分数=___________(用含w 、m 、m2 的代表式表示)
(五)问题和讨论
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与C之间加入一个装置,再次实验后,得到了较正确的结果,那么,原来实验所测得的铜的质量分数偏小的原因可能是_________________________,在B与C之间加入的装置可以_____________,其中盛放的
药品是______________。
六、计算题(10分)
24. (10分) 已知H2S在O2足量的条件下燃烧生成SO2和水、在O2不足的条件下燃烧生成S和水。现标准状况下。将100mLH2S和O2的混合气体点燃,恢复到原来状况。发现随混合气体中O2所占体积V(O2)的变化,反应后所得气体总体积V(总)也在变化,如右图所示。
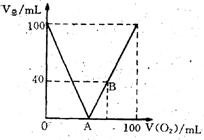 (1)写出A、B两点横坐标值及化学方程式:
(1)写出A、B两点横坐标值及化学方程式:
A点值_______,
A处方程式____________________________;
B点值_______,
B处方程式____________________________。
(2)填表(气体体积单位:mL)
| V(总) | V(O2)范围值 | V(总) 中气体成分 |
| ①大于40 | ||
| ②小于40 | ||
| ③等于40 | ||
元素化合物综合练习(一)
参考答案
| 1 | C | 2 | D | 3 | B | 4 | C | 5 | D |
| 6 | D | 7 | D | 8 | A | 9 | D | 10 | C |
| 11 | B | 12 | B | 13 | D | 14 | D | 15 | A |
| 16 | D | 17 | B | 18 | D |
| |||
19.(1)4;XeF2 (2)XeF2+2OH-+BrO3-=Xe+2F+BrO4-+H2O
(3)pH越大,BrO4-越稳定
20.AgNO3、MgCl2、CuSO4、NaOH
(1)Ag++Cl-=AgCl↓(2)Mg2++2OH-=Mg(OH)2↓(3)Cu2++2OH-=Cu(OH)2↓
21.(1)A:FeCl3;F:O2;H:AgCl (2)2Al+Fe2O3 Al2O3+2Fe
(3)FeCl3·6H2O受热后,FeCl3先水解,生成Fe(OH)3和HCl,生成的Fe(OH)3受热分解得Fe2O3,而HCl挥发得HCl气体。
22.(1)Al2O3;Cl2;Al(OH)3 (2)三,Ⅲ A (3)MnO2+4H++2Cl- Mn2++
Cl2↑+2H2O Al(OH)3+OH-=AlO2-+2H2O (4)铝遇到冷浓硝酸钝化
(5)0.5mol
23.㈠铜粉样品中铜含量的测定
㈡
| 打开A的活塞,慢 慢滴加溶液 | 产生大量气泡 | MnO2 2H2O2= 2H2O+ O2↑ | ||||
| 对C进行加热。 当C中的药品充分 反应后。关闭A的 活塞,停止加热 | 铜粉由红褐变黑色 |
2Cu+ O2=2CuO C +O2==CO2 |
㈣{w-[12(m-m)/44]}/w ×100%
㈤ O2不干燥, 水分进入D;洗气瓶, 浓硫酸。
26.解: ⑴A点表示气体的体积为0
2H2S+O2=2S+2H2O V(O2)=33.3mL
B点表示O2过量, 将有SO2 生成, 利用元素守恒
(40+x) H2S+(60-x)O2 =xS+ 40SO2+(40+x) H2O
(60-x)×2=40×2+40+x x=0 说明恰好燃烧生成SO2
方程式是: 2H2S+3O2 = 2SO2+2H2O V(O2)=60mL
⑵①V(总)>40 Ⅰ左边线段:, 剩余气体是H2S
2H2S+O2=2S+2H2O V(O2)=(100mL-40mL)/3=20mL范围: 0<V(O2)<20mL
Ⅱ右边线段, 气体是SO2 、O2, 利用差量法
2H2S+3O2 = 2SO2+2H2O V(O2) =100mL-40mL =60mL范围: 60mL<V(O2)<100mL
②V(总)<40 Ⅰ左边线段: 剩余气体是H2S 范围: 20mL<V(O2)<33.3mL
Ⅱ右边线段, 气体是SO2 范围: 33.3mL<V(O2)<60mL
| V(总) | V(O2)范围值 | V(总) 中气体成分 |
| ①大于40 | 0<V(O2)<20mL | H2S |
| 60mL<V(O2)<100mL | SO2 、O2 | |
| ②小于40 | 20mL<V(O2)<33.3mL | H2S |
| 33.3mL<V(O2)<60mL | SO2 | |
| ③等于40 | V(O2)=20mL | H2S |
| V(O2)=60mL | SO2 |
答: 略
 实验现象
实验现象 有关化学方程式
有关化学方程式