高三化学月考试卷
化 学
第Ⅰ卷(选择题 共58分)
一、选择题:(每小题只有一个正确选项,每小题2分,共40分)
1.下列物质中,属于纯净物的是 ( )
A.漂白粉 B.明矾 C.氨水 D.铝热剂
2.下列物质中,溶于水或高温条件下均不能产生氧气的是 ( )
A.过氧化钠 B.氯酸钾 C.硝酸 D.小苏打
3.工业上制取下列物质,不需要用石灰石的是 ( )
A.炼铁 B.电冶铝 C.普通玻璃 D.水泥
4.合成氨工业上,为提高NH3的产率,可采取的措施是 ( )
A.使用合适催化剂 B.采用较高压强
C.采用较高温度 D.采用较低压强
5.相同温度下,同物质的量浓度的碳酸钠溶液和碳酸氢钠溶液的PH值 ( )
A.前者大 B.后者大 C.相同 D.无法判断
6.向盛有氯化钡溶液的甲、乙两试管中,分别通入SO2至饱和,若向甲试管中加入适量硝
酸,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是 ( )
A.两试管均有白色沉淀生成 B.两试管均无白色沉淀生成
C.甲试管有沉淀而乙试管没有 D.甲试管无沉淀而乙试管有
7.大炭粉与浓硝酸共热产生的气体等分为①和②两份,第一份先导入适量蒸馏水,再导入
澄清石灰水;第二份直接导入澄清石灰水,则石灰水的变化可能是 ( )
A.①不变浑浊,②变浑浊 B.①变浑浊,②不变浑浊
C.①与②都变浑浊 D.①与②都未见沉淀
8.近年来,我国许多城市禁止汽车使用含铅汽油,其主要原因是 ( ) A.提高汽油燃烧效率 B.降低汽油成本
C.避免铅污染大气 D.铅资源短缺
9.把等体积的AlCl3与NaOH溶液混合后,反应生成的沉淀物中含铝物质的量与溶液中含铝
物质的量相等,则原AlCl3、NaOH溶液的物质的量浓度之比为 ( )
A.1∶3 B.2∶5 C.1∶4 D.2∶7
10.已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn—的核外电子排布相同,则下列关系式正确的是 ( )
A.a = b+ m +n B.a= b-m +n C.a = b + m-n D.a = b-m-n
11.一定条件下,将等体积的NO和O2混合气体置于试管中,并将试管倒立于盛有足量水的水槽中,充分反应后剩余气体的体积约为原混合气体总体积 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
12.4.60 g铷(85.4g·mol-1)与另一种碱金属的合金,与水反应得2.24 L气体(标准状况),另一种碱金属是 ( )
A.Li(6.9g· mol-1) B.Na(23g· mol-1)
C.K(39g· mol-1) D.Cs(133g· mol-1)
13.需要加入还原剂才能实现的变化是 ( )
A.MnO2→MnO4- B.AlO2-→Al(OH)3
C.AsO43-→AsO33- D.S2O32-→SO32-
14.NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 L 0.5 mol· L-1的硫酸铁溶液中,Fe3+的数目为0.1NA
B.3.1g铜粉与足量硫点烧后充分反应,电子转移数目为 0.1 NA
C.2.7g铝粉投入足量氢氧化钠溶液中,被还原的水分子数为0.1 NA
D.3.1g白磷固体中含有P- P单键数为0.15 NA
15.38.4 mg铜跟适量浓硝酸反应,铜全部作用后,共收集到标准气体22.4 mL,反应消耗HNO3的物质的量可能为 ( )
A.1.0×10-3 mol B.1.6×10-3 mol C.2.2×10-3 mol D.2.4×10-3 mol
16.5.1g Mg、Al合金500 mL 2 mol· L-1盐酸中,完全反应后再加入4 mol· L-1氢氧化钠溶液,若沉淀量达到最大值,则加入NaOH溶液的体积为 ( )
A.250 mL B.425mL C.500mL D.560mL
17.只用一种试剂就可将AgNO3、KSCN、稀H2SO4、NaOH四种无色溶液区分开来,该试剂是 ( )
A.BaCl2溶液 B.FeCl3溶液 C.FeCl2溶液 D.Fe(NO3)3溶液
18.下列说法正确的是 ( )
A.健康人血液的PH值小于7
B.硫酸铁溶液加热蒸干后灼烧,所得固体为Fe2O3
C.二氧化硅晶体中,每个硅原子与4个氧原子结合
D.鉴别Na2CO3溶液和NaHCO3溶液可用石灰水
19.检验Na2SO3是否部分氧化所用的试剂是 ( )
A.Ba(NO3)2和HCl B.BaCl2和HCl
C.Ba(OH)2和稀HNO3 D.Ba(NO3)2和稀HNO3
20.密度为0.91g· cm-3的氨水,其质量分数为25%,该氨水用等体积的水稀释后,所得溶液的质量分数为 ( )
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
二、选择题(每小题有1—2个正确选项,每小题3分,共18分)
21.一小块铜片投入稀硫酸中,铜片不见溶解,再加入下列何种试剂,铜片开始溶解,这种试剂可能是 ( )
A.Fe2(SO4)3 B.KNO3 C.Na2CO3 D.FeSO4
![]() 22.在密闭容器中发生如下反应:a
X(g) +b Y(g) c Z(g)
+d W(g),反应达到平衡后,保持湿度不变,将气体体积压缩到原来的
22.在密闭容器中发生如下反应:a
X(g) +b Y(g) c Z(g)
+d W(g),反应达到平衡后,保持湿度不变,将气体体积压缩到原来的![]() ,再次达到平衡时,W的浓度为原平衡时的1.8倍,下列叙述中不正确的是 ( )
,再次达到平衡时,W的浓度为原平衡时的1.8倍,下列叙述中不正确的是 ( )
A.平衡向逆反应方向移动 B.a+b>c+d
C.Z的体积分数增加 D.X的转化率下降
23.某铁的氧化物,用7 mol/ L的盐酸100 mL在一定条件下恰好完全溶解,所得溶液再通入0.56L标准状况下的氯气时,刚好使溶液中Fe2+完全转化为Fe3+,则该氧化物的化学式可表示为 ( )
A.FeO B.Fe3O4 C.Fe4O5 D.Fe5O7
24.CO和H2组成的混合气体3.2g完全燃烧,将生成的产物全部通过足量Na2O2固体,充分反应后,固体质量增加了 ( )
A.3.2g B.6.4g C.8g D.无法计算
25.下列离子方程式正确的是 ( )
![]() A.氯气水反应: Cl2
+ H2O
2H+ +Cl- +ClO-
A.氯气水反应: Cl2
+ H2O
2H+ +Cl- +ClO-
B.氢氧化钡溶液中加入稀硫酸:
Ba2+ + SO42- BaSO4↓
C.往小苏打溶液中滴加少量氢氧化钙溶液:2HCO3-+Ca2++2OH- CaCO3↓+CO2-+2H2O
D.侯德榜制碱的主要反应原理:
CO2+NH3+Na++H2O NaHCO3↓+NH4+
26.常温下,将A L SO2和B L H2S混合后,当反应后气体体积是反应前气体体积的![]() 时,则A与B之比是 ( )
时,则A与B之比是 ( )
A.1∶1 B.1∶2 C.1∶3 D.2∶1
第Ⅱ卷(非选择题 共42分)
三、填空题(第27题每格1分,其余每格2分,共32分)
27.为了方便某些化学计算,常常将某些含氧化合物改写成氧化物的形式,如H2SO4用SO3·H2O表示,其它化合物也有相应表达,根据已学有关知识,用化学式表示下列物质的成分:(1)Mg2SiO4: (2)Pb3O4:
(3)H3PO4: (4)Fe3I8:
28.(1)6.2g Na2O和93.8g水混合后溶质的质量分数与7.8g Na2O2和 g水混合溶液的质量分数相等,其质量分数为 。
(2)两装有足量盐酸的等质量的烧杯置于天平两端,天平平衡,下列情况能使天平依然平衡的有 (用标号回答)①相同质量的KHCO3和CaCO3②相同物质的量的MgO和MgCO3 ③相同物质的量的Na和Mg
29.一无色气体,可能由CO2、HCl、NH3、、NO2、H2中的一种或几种所组成。将此无色气体通过盛有浓H2SO4的洗气瓶,气体体积减少一部分;继续通过装有足量Na2O2的干燥管,出来的气体显红棕色;再将该气体通入盛满水且倒立于水槽的试管内,发现倒立试管水位上升,最后充满试管。由此可见:
(1)原气体一定会有 ,一定没有
(2)原气体中 气体的体积比为
|
(1)与CO2反应后形成的溶液中溶质为 ,
该溶液还可溶解大约 mol的CO2气体。
(2)加入盐酸后能产生标准状况下的气体 mL。
(3)原NaOH溶液的物质的量浓度为 mol/ L。
31.(1)室温下,由水电离产生的C(OH-)为1.0×10-12 mol/ L
的溶液,PH值可能为
(2)向FeCl3溶液中加入a g铜粉,搅拌全部溶解,然后向其中加入b g铁粉,充分反应后过滤得滤渣c g,已知a>b>c,则c g滤渣应为 ,所得滤液中含有的金属离子为 。
四、计算题(第32题4分,第33题6分)
32.加热14.5g某铁的氧化物,同时通入足量CO所体,将反应后的气体全部被澄清石灰水吸收,得到25g沉淀,通过计算确定该氧化物的化学式。
33.标准状况下进行下列实验:甲、乙、丙各取30.0 mL同浓度的盐酸,加入同一种镁铝合金,所取合金质量和产生气体的体积在表所列,求:
(1)盐酸的物质的量浓度;
|
(3)丙实验后,还需向容器中加入1.00mol/ L的
NaOH溶液多少mL才能使剩余合金中的铝粉
恰好完全溶解。
化学参考答案
一、选择题:1.B 2.D 3.B 4.B 5.A 6.A 7.B 8.C 9.D 10.A 11.C 12.A 13.C 14.D 15.C 16.A 17.B 18.C 19.B 20.C
二、选择题:21.AB 22.BC 23.D 24.A 25.CD 16.AC
三、填空题:
27.(1)2Mg·SiO2 (2)2PbO·PbO2 (3)P2O5·3H2O (4)3FeI2·I2
28.(1)93.8 g, 8% (2)①②③
29.(1)一定含有O2、NH3、NO,一定没有HCl、NO2、H2 (2)CO2与NO气体的体积比为3∶2
30.(1)溶质为NaCO3、NaHCO3,2.5×10-3mol CO2 (2) 112 mL (3)0.75 mol/ L
31.(1)12或2 (2)Cu+,Cu2+、Fe2+
四、计算题:
32:解:FeOx + 2CO x CO2 + Fe
56 +16x x
14.5
0.25 x = ![]() ∴氧化物Fe3O4或FeO、Fe2O3
∴氧化物Fe3O4或FeO、Fe2O3
答:该氧化物化学式为Fe3O4或Fe2O3。
33.(1)∵乙或丙中H2为0.03 mol,且盐酸已反应完全 ∴CHCl=![]() mol·L-1
mol·L-1
(2)设Mg、Al分别为x、y摩尔
甲中![]() m mol
m mol
∴![]()
(3)解:丙中Mg、Al都为![]() 根据题意由电荷守恒可得
根据题意由电荷守恒可得
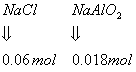
![]()
答:(1)盐酸的物质的量浓度为![]() ;(2)合金中Mg的质量数为47%;
;(2)合金中Mg的质量数为47%;
(3)还需NaOH溶液78 mL