高三化学专题练习——推断题
一、
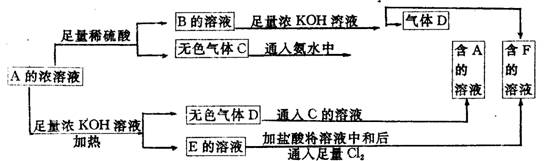 从物质A(某正盐)的水溶液出发有下图所示的一系列变化。写出A、B、C、D、E、F的化学式。
从物质A(某正盐)的水溶液出发有下图所示的一系列变化。写出A、B、C、D、E、F的化学式。
 A B
C D
E F
A B
C D
E F
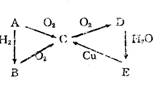
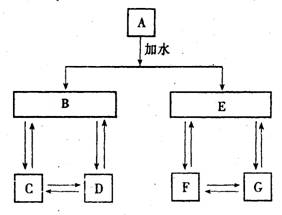
2 A、B、C、D、E有图中所示物质间的相互转化关系,试推断:
(1)若A为气体时(常温下),则A 是 ,B是 ,C是 ,D 是 ,E是 ;
(2) 若A是固体时(常温下),则A 是 ,B是 ,C是 , 是 ,E是浓 ;
3 某元素X它的气态氢化物中共有10个电子,该元素最高正价和负价绝对对值之差为2 ,X的最高价氧化物溶于水生成Y,Y可与烧碱反应生成Z,则⑴元素X的名称为 ;
 ⑵X→Y 的化学方程式为
;⑶Y→Z的化学方程式
;⑷写出Y受热分解的方程式
⑵X→Y 的化学方程式为
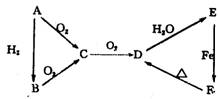
;⑶Y→Z的化学方程式
;⑷写出Y受热分解的方程式
4 下面各物质之间的转化关系如图所示,对A、B、C、D、E、F六种物质可能有两组不同的答案:(A的单质)
第一组:A ,B ,C ,D ,E ,F ;
第二组:A ,B ,C ,D ,E ,F ;
5 有AB两种可可溶性无机物,溶于水后,将它们混合进行如下实验:
写出下列物质的化学式:
A 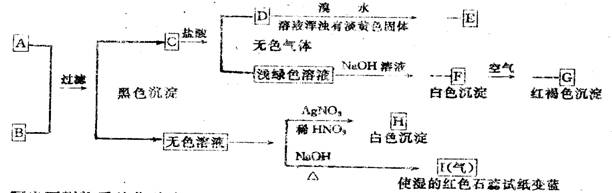 ,B , C ,D
,E
,F
,G ,H ,I ;
,B , C ,D
,E
,F
,G ,H ,I ;
6 有A、B、C、D、E、F、G、W八种气体,进行如下实验:⑴分别将八种气体通入水中发现E、F难溶于水,其它气体可溶,其中A、D极易溶于水,W溶于水时有F气体生成。⑵A经催化氧化得F,C在空气中充分燃烧可得G。⑶C、D遇酸化的硝酸银分别有黑色沉淀和白色沉淀生成 。⑷B与E化合得D,D与A相遇有大量白烟生成 ;
则:A ,B ,C ,D ,E ,F ,G ,W ;
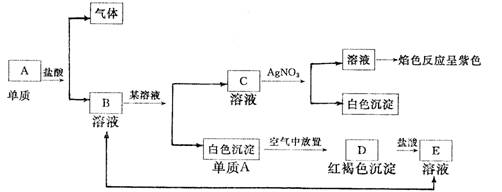
7根据下列实验分别指出A、B、C、D、E各是什么物质
A ,B ,C ,D ,E
 |
8 下图中每一方格表示一种反应物或生成物,其中A、C为无色气体,填写空白:
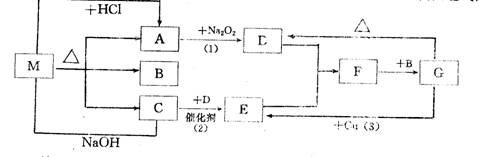 物质M可能是
或
,C是
,F是
物质M可能是
或
,C是
,F是
写出下列反应的化学方程式:
⑴ ⑵
⑶ 。
9 现有A、B、C、D、E五种溶液,由下列阴、阳离子组成,(每种溶液中所含阴、阳离子各不相同)。阳离子可能是:Ag+、NH4+、Mg2+、Cu2+、Ba2+、Al3+;阴离子可能是Cl—、HCO3—、NO3—、SO32—、SO42—、PO43—;试根据下列实验事实推断A、B、C、D、E各是什么物质。
(1) 加入氨水,A、C、E都生成沉淀,其中C的沉淀溶于过量的氨水;加入NaOH溶液于上述A、E沉淀中,A的沉淀溶解,E沉淀不溶解。
(2) 将D溶液分别加入A、B、C、E中,只有E无沉淀生成;在沉淀中分别加入盐酸,A、C的沉淀不变,B的沉淀溶解。
(3) 在B、E中分别加盐酸,都产生使澄清石灰水变浑浊的气体;若将B、E分别与NaOH溶液共热,B有气体放出。
| 物质 | A | B | C | D | E |
| 化学式 |
10 某待测液中可能含有Fe2+、Fe3+、Al3+、Ba2+
、Ca2+、NH4+等离子。进行了下列实验(所加酸、碱、氨水、溴水都是过量的)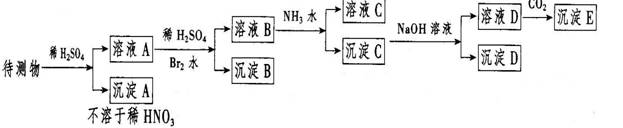
根据实验结果:
(1) 判定待测液中有无Ba2+ 、Ca2+,并写出理由
(2) 写出D的化学式
(3) 写出从溶液D生成沉淀E反应的离子方程式:
11、有机物A 是一种具有芳香气味的液体,其分子式:C4H8O2,它在硫酸存在下水解生成B和D化合物,B和D可发生下列转化:
![]() 浓H2SO4
+O2催化剂 △
O2
浓H2SO4
+O2催化剂 △
O2
![]()
![]()
![]() E
B
C
D
E
B
C
D
170℃ +H2催化剂 △ △ 催化剂
⑴试回答:A的结构式
⑵完成化学反应(要求写结构简式并配平,注明反应条件)指出反应的类型
⑴B→C ,反应类型
⑵B→E ,反应类型
12有A、B两种酯,其组成含碳均为54.5%,含氢9.1%,其蒸气密度为39.4g/L(标准状况),A与B能发生如下所示的反应,经测定其B、E、G、H、L、I均能与银氨溶液发生反应,且分子中不含支链。
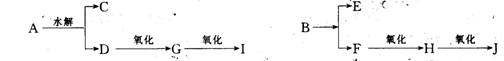
⑴试写了出下列物质的结构简式:A ,B ,C
D ,E ,F 。
⑵试写出A水解的化学方程式 。
13 分子式为C7H14O2有机物A和稀NaOH溶液共煮生成B和C。B的无水物和碱石灰共热可得到含氢为25%的气态烃。C的分子中含5个碳原子,能与金属钠反应放出气体,不能脱水生成含相同碳原子数的烯烃。D和C互为同分异构体。D分子中有一个支链且可以脱水生成两种不同的烯烃。则A、B、C三种有机物的结构简式依次是:A B C D的一种符合题意的结构简式是 。
14 有A、B、C、D四种元素,它们均为短周期元素。A和B两种元素的原子各有两个电子层;C和D两种元素的原子各有三个电子层。A和B能化合成无色、无味的气体AB2;C和D能形成CD型化合物。B和D同族。B的离子和C的离子的核外电子数相等。则这四种元素的符合分别是:
A B C D
 15 有A、B、C、D、E、F、G七种常见物质,它们满足右图所示的转化关系。已知:⑴A、B、C、D、E、F、G都不是氧化物,⑵D G是钠盐 ⑶A、B、C、D含同一种元素,⑷且F为单质,⑸E在常温下为气体。请回答:
15 有A、B、C、D、E、F、G七种常见物质,它们满足右图所示的转化关系。已知:⑴A、B、C、D、E、F、G都不是氧化物,⑵D G是钠盐 ⑶A、B、C、D含同一种元素,⑷且F为单质,⑸E在常温下为气体。请回答:
⑴写出A、F的化学式A F
⑵写出下列反应的离子方程式①D→C
②C+D→B
16 有A、B、C、D、E五种元素,它们的质子数依次递增,且都小于18。A元素原子核外只有1个电子;B元素原子和C元素原子最外层电子数之差为2,B元素原子最外层上的电子数为次外层电子数的2倍;B、C、D三种元素可以形成化学式为D2BC3的化合物,其焰色反应为黄色;0·5摩E的单质与足量的酸反应有9·03×1023个电子发生转移,在E和C形成的化合物中E的质量分数约为53%;又知E的原子核中有14个中子。
⑴画出D原子、E阳离子的结构示意图:
, 。
⑵写出D2C与A2C反应的化学方程式: ;
⑶E的最高价氧化物对应的水化物和D的最高价氧化物对应的水化物发生反应的离子方程式为 。
17 A、B、C、D都是含钠元素的化合物,它们分别跟硫酸或氢氧化钠溶液反应的情况如下:
⑴A+ H2SO4→D+X↑ ⑵B+ H2SO4→D+Y↑+ H2O ⑶ A+B+ H2SO4→D+Z↓+ H2O
⑷ C+NaOH→D+ H2O
A B C D X Y Z
18.A、B、C、D、E五种物质在一定条件下的相互反应如图所示,已知A为固体单质,判断这五种物质的化学式。
![]()
![]() A O2 O2 D A B C D E 。
A O2 O2 D A B C D E 。
![]()
![]() H2 催化剂 H2O
H2 催化剂 H2O
![]()
![]() C 加热
C 加热
 B O2 Cu E
B O2 Cu E
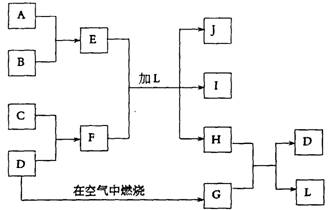
19.下图每一方框中的字母代表一种反应物或生成物:产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(l)L的化学式为: 。(2)F的化学式为: 。
(3)写出J受热分解反应的化学方程式: 。
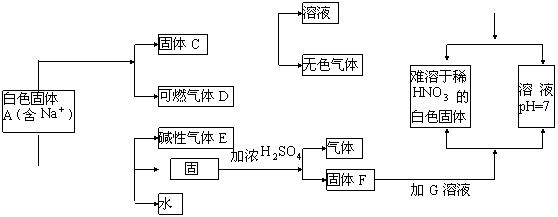
(4)H和G之间反应的化学方程式为: 。
20下图是中学化学中常见的物质间化学反应关系图示,其中未注明用量的物质间的反应均按恰好充分反应处理,其它有关信息已在框图中说明:
加少量BaCl2溶液
![]()
![]() 加白色粉末
加白色粉末
△
![]() 加白色固体B
加白色固体B
△ 微热
(1)写出下列物质的化学式:
A: B: D: E: F: C:
(2)写出下列反应的化学方程式:A→D
(3)白色固体B的化学式是否能确定 (填是或否),
理由是 。
21 A、B两种盐均为无色晶体,其中A的焰色反应呈紫色(透过蓝色钴玻璃),A的水溶液pH值大于7。下面是A、B两种盐所进行的实验记录(见下图),其中H、G均为不溶于酸的白色沉淀。
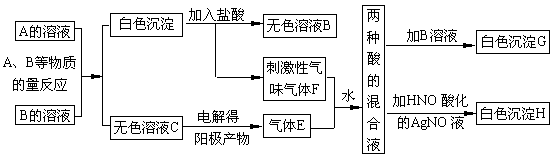
(1)写出A、B两种盐的化学式A___________B___________。
(2)写出A、B反应的离子方程式_______ 。
(3)写出F+E+H2O反应的化学方程式 。
|
|
(4)电解C的无色溶液,阴、阳两极所得气体的体积比理论值为1∶1,而实际收集到的气体的体积比却大于1∶1,简单解释原因__________ 。
22、有A、B、C、D、E五种物质,它们的变化关系如图所示。已知A是一种金属单质,B是一种红棕色粉末,试推出它们各是什么物质。(填化学式)
A_________________
B__________________
C__________________
D__________________
E__________________
答案:1 (NH4)2SO3 B (NH4)2SO4 C SO2 D NH3 E K2SO3 K2SO4 2 ;(1)N2、NH3、NO、NO2、HNO3; (2)S 、H2S、SO2、H2SO4 3 氮元素、N2O5+H2O====2HNO3、 HNO3+NaOH===NaNO3+H2O,4HNO3===2H2O+4NO2↑+O2↑ 4 N2、NH3、NO、NO2、HNO3、Fe(NO3)3 ; S 、H2S、SO2、SO3 、H2SO4、Fe2(SO4)3 5 5 NH3、Cl2 、H2S、HCl、H2、NO、SO2、NO2;6 A :FeCl2;B (NH4)2S (或A: (NH4)2S B FeCl2) C FeS,D H2S E S F Fe(OH)2 G Fe(OH)3 H AgCl I NH3 7 Fe、 FeCl2、KCl、Fe(OH)3 、、 FeCl3 8 NH4HCO3、(NH4)C3;NH3; NO2 ;2CO2+2Na2O2===2Na2CO3+O2 4NH3+5O2====4NO+6H2O
3Cu+8HNO3===3Cu(NO3)2+2NO↑4H2O 9 Al2(SO4)3 (NH4)2SO4 AgNO3 BaCl2 Mg(HCO3)2 10 含有Ba2+ 或Ca2+的一种或两种,因BaSO4不溶于水,CaSO4微溶于水。 Fe(OH)3 2AlO2—+CO2—+3H2O===2Al(OH)3↓+CO32— 13 CH3COOCH2(CH3)3 CH3COONa (CH3)3CCH2OH (CH3)2C(OH)CH2CH3 14 C O Mg S


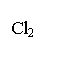 O2 CO
O2 CO